コロイダルシリカとは、コロイド粒子状のシリカです。
コロイドとは、ある物質が直径2~500nm程度の微粒子や液滴となって、別の物質中に分散している状態で、ゾルとは、これら微小なコロイド粒子と分散媒の混合物を指します(Fig1)。このため、コロイダルシリカは、別名シリカゾルと呼ばれることもあります。
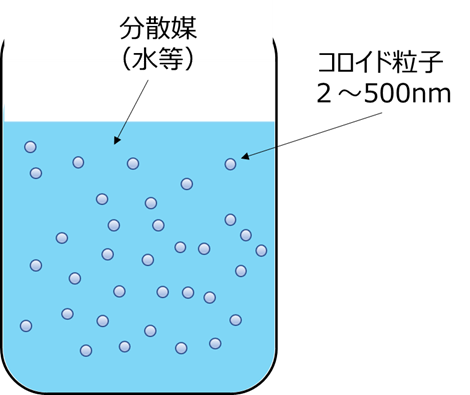
Fig1. コロイド粒子のイメージ
コロイダルシリカ
コロイダルシリカは、ケイ酸モノマーから脱水縮合によりケイ酸ダイマーからオリゴマーを経て形成された球状粒子が、水等の液体に分散しているものとなります。
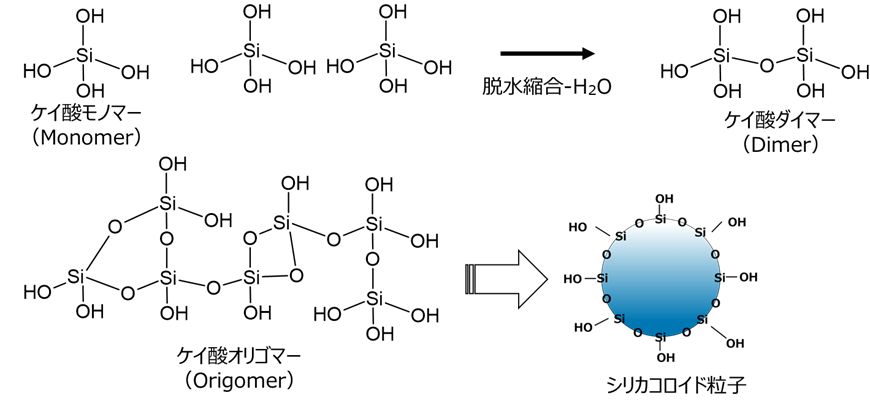
Fig2. シリカコロイド粒子の形成
コロイダルシリカは、文字通りシリカコロイド粒子が水等の液体に分散したもので、コロイドの粒子径により透明度が異なります。これは、光が光の波長よりも粒径の小さい粒子にぶつかったときに起こるレイリー散乱によるもので、粒子径が大きくなるほど散乱強度が強くなるために、肉眼では白色が強くかつ濁りが強くなっているように見えます。
一般に、コロイド粒子は1µm以下のサブミクロン領域の粒子の散乱が極大となり、白色度が最も強くなります。コロイダルシリカでは、粒子径30nmを境に30nmを超える粒子は液が白濁し、この白濁は粒子径が大きくなるにつれ強くなります。一方、粒子径が30nm以下では粒子径が小さくなるほど透明に近づいていきます。
この白から透明への現象はコロイダルシリカの大きさを知る大きな手がかりとなり、例えばコロイダルシリカがゲル化をすると粒子径が大きくなり、白っぽく濁るため、凝集(ゲル化)の有無も確認できます。

Photo1. コロイダルシリカ各種1)
レイリー散乱
コロイダルシリカの物性を説明する際にレイリー散乱は非常に重要となります。
レイリー散乱とは、光(可視光)の波長よりも十分小さい粒子による散乱です。
可視光の波長は400~700nm、コロイダルシリカの粒子径は数~数十nmとなり、波長に比べて粒子径が小さいため、レイリー散乱が起こります。
レイリー散乱はわれわれの生活の中でも身近に起こっています。
光が粒子にぶつかると四方八方に散らばり、これを散乱といいます。
この散乱は、自然界の中でも起こっていて、例えば、太陽光が大気中の塵埃(じんあい)などにぶつかると、四方八方に散らばります。
太陽光線には様々な色の光が含まれていますが、その中でも特に青い光は散乱が起きやすいため、空が青く見えます。
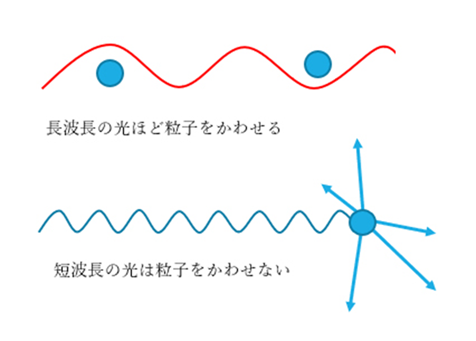
Fig3. 大気中の散乱イメージ2)
基本原理
コロイダルシリカを作るには、一次粒子をゲルさせずにいかに水中分散させるかがキーポイントとなります。
ここでいうゲル化とは、一次粒子が集まり3次元ネットワークを形成することです。
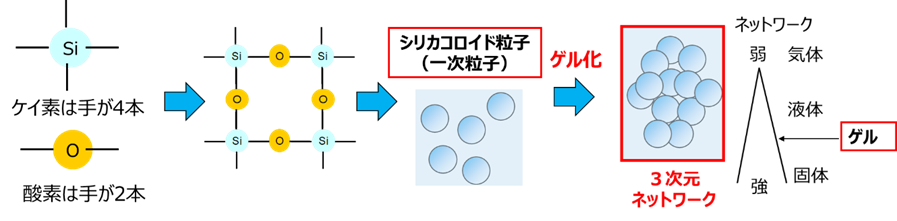
Fig4. 一次粒子の形成とゲル化のイメージ
ゲル化の制御
コロイダルシリカの場合、水中でのゲル化を抑えなければなりません。
Fig5で示すようにシリカのゲル化にはルールがあり、このルールに従い、ゲル化を抑えることでコロイダルシリカとなります。
ケイ酸モノマー(一量体)は、脱水縮合により二量体から四量体のようなオリゴマー、環状を経て球状粒子となりこれ一次粒子と呼びます。このときpHを7以下、または塩化ナトリウムのような金属塩の存在下でpHを7-10に調整したものは、一次粒子径が小さいままで集合体を形成します(反応経路A)。
一方、pHを7-10に調整したものは、一次粒子単独で成長する方向で反応が進みます(反応経路B)。
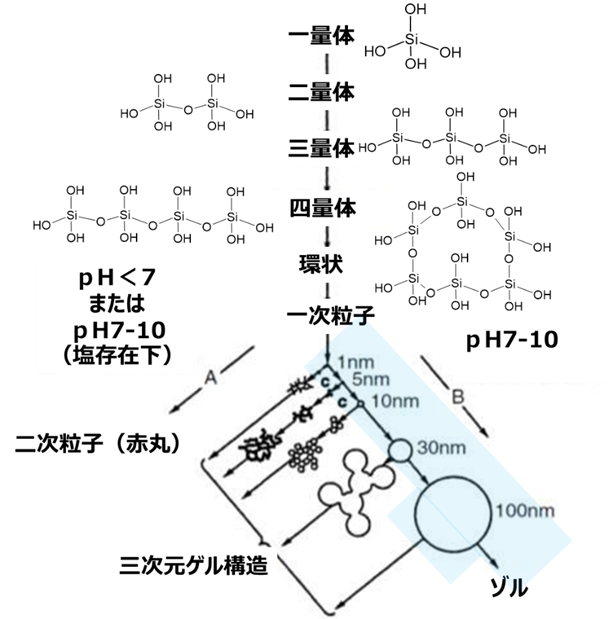
Fig5. コロイダルシリカの形成過程3)
このとき、青色の部分が水中で単分散の粒子で存在することでコロイダルシリカとなります。コロイダルシリカは別名シリカゾルとも呼ばれていてゾルの一種です。
したがって、ゾルで存在させるためにはBの方向に反応を向かわせる必要があり、pHと電気二重層によるコントロールが重要となります。
pHによるコントロール
前述しましたように、コロイダルシリカが安定に存在するには、pHのコントロールが大変重要です。
Fig4は、シリカのゲル化時間とpHの関係を表したもので、縦軸のゲル化時間が長いほどゲル化がし難い、つまりコロイダルシリカとして単分散で安定しやすいということになります。反面、ゲル化時間が短い場合は、コロイダルシリカとして存在せずすぐにゲル化してしまうことになります。
シリカのゲル化は、pHにより安定領域、準安定領域にわかれます。
安定領域
pH が6を超えると急激急激にゲル化時間が長くなります。この内、pH8-11を安定化領域といい、このpHの範囲で、一次粒子は、コロイダルシリカとして水中で安定して存在しますが、更にpHを上げると一次粒子は溶解をしてしまうため注意が必要です。
準安定領域
また、規定域からpHを上昇させていくとゲル化時間は長くなり、pH2.5付近でピークを示し、その後pHの上昇によりゲル化時間が短くなります。このpH2-4もコロイダルシリカとして安定して存在します。しかし、安定領域ほどゲル化時間が長くないため、準安定領域といいます。
従って、準安定領域と安定領域の間のpH5-6が最もゲル化時間が短く、もっとも不安定な領域となります。
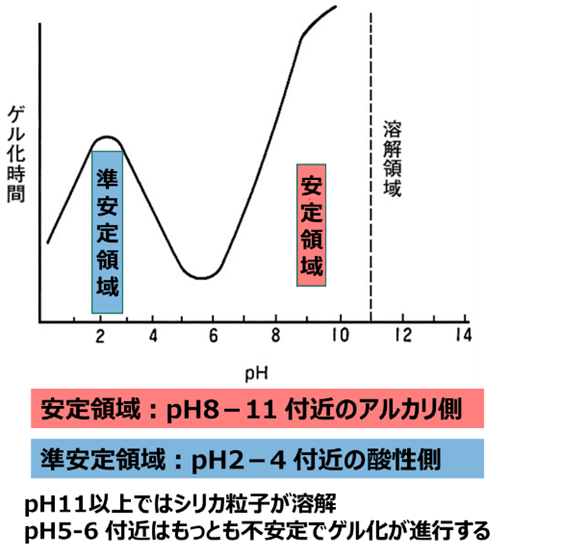
Fig6. pHとゲル化の関係
電気二重層
コロイダルシリカが安定して水中で存在するには、電気二重層も重要となります。
先にも述べましたように、一次粒子が成長するとコロイダルシリカになり、が単分散で存在するか凝集するかは、電気二重層が大きくかかわってきます。
一般に2つの異なる物質が接する界面には電位差が生じます。そのため、どちらかの物質中で荷電粒子が移動可能であれば、界面には必ず電気二重層が形成されます(Fig7)。

Fig7. 電気二重層とゼータ電位の関係4)
電気二重層とは、水電解質溶液中で固体表面が帯電すると,その電荷を打ち消すように正味の反対電荷が表面近傍の溶液中に分布することで形成され、コロイダルシリカ、のようなシリカ一次粒子の場合、一次粒子はマイナスに帯電しているため、それを打ち消す形で表面はプラスの電荷で覆われています。このプラスに帯電している相を固定層(Stern-Helmholtz層)といいます。この固定層より外側の静電引力の中で拡散しつつ濃度分布が生じる層を拡散層(Gouy-Chapman層)といい2つの層で構成されています。
ゼータ電位
ゼータ電位とは、溶液中の微粒子の周りに形成する電気二重層中の液体流動が起こり始める「すべり面」の電位として定義されます。 これがゼロに近づくと、微粒子の相互の反発力は弱まりやがて凝集してしまいます。
つまり、ゼータ電位が大きいときはシリカ一次粒子どうしがが安定するため分散していますが、ゼータ電位が小さいと不安定になり、一次粒子どうしがくっつきあって凝集します。このため、シリカのゲル化にはゼータ電位の制御がとても重要になります。

Fig8. ゼータ電位による分散と凝集のイメージ4)
コロイダルシリカを安定させるために、アルカリ金属などの電解質を添加します。添加により系全体のイオン濃度が上昇してゼータ電位が大きくなり安定化しますが、過剰添加によりゲル化するため、添加量には注意が必要です。
これは、過剰添加により、コロイドの安定化粒子の表面と電解質で釣り合っている範囲を超えてしまい、このとき、イオンが粒子表面に吸着して電荷が中和されることでゲル化が起こるためです。
また、ゼータ電位を大きくしてコロイダルシリカを安定させる方法としてコロイダルシリカの表面を処理する方法もあります。
工業的製法
工業的なコロイダルシリカの製法には、原料にケイ酸ソーダを用いる方法(水ガラス法)5)、テトラメトキシシラン(TMOS)などのアルコキシシランを用いる方法(アルコキシド法)6)等があります。
水ガラス法
原料にケイ酸ソーダ(水ガラス)用いる方法で、ケイ酸ソーダ(Na2O・SiO2)に水を加えて数%まで希釈します。この水溶液を予め加温した水酸化ナトリウム水溶液に少量ずつ投入して反応させます。
反応後、数時間沸騰還流をして、限外ろ過を行いアルカリシリカゾルが得られます。この状態でコロイダルシリカは生成していますが、ナトリウムイオン(Na+)や、塩化物イオン(Cl–)、硫酸イオン(SO42-)、硝酸イオン(NO3–)等の不純物が大量に含まれているため、イオン交換によりこれらのイオンを水素イオン(H+)や水酸化物イオン(OH–)に交換することにより除去します。
これらのイオンを除去したことにより、pHは酸性となり、酸性シリカゾルが得られますが、このシリカゾルは非常に不安定でゲル化しやすいため、アルミン酸ソーダ等のアルカリ金属水酸化物水溶液やアンモニア水アミン等の安定化剤を加えます。安定化剤は、ゲル化を抑えるとともにpH調整の役割を果たしていて、前述しましたpHによる安定領域と電気二重層の理論を用いて巧みに制御されています。
アルカリシリカゾルや酸性シリカゾルにもコロイダルシリカは生成していますが、アルカリシリカゾルは不純物が多く、酸性シリカゾルは不安定のため、これらは工業的にはコロイダルシリカとは言わず、安定化剤を加えて安定化させたものがコロイダルシリカになります。
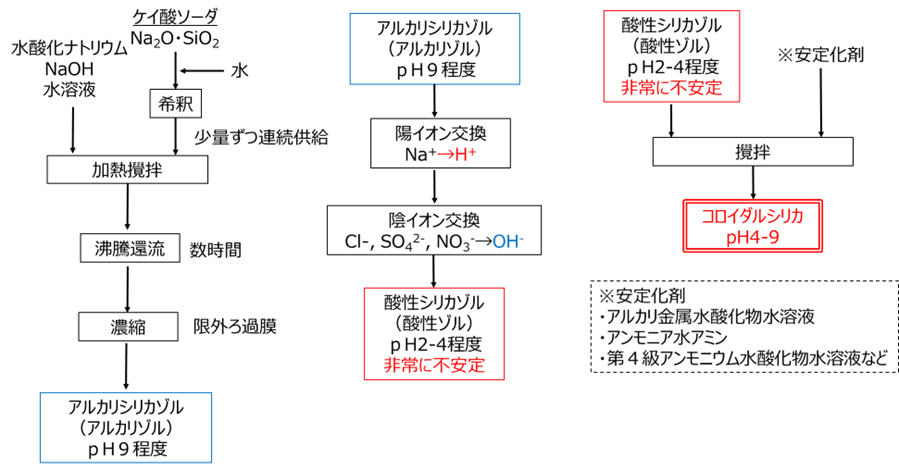
Fig9. 水ガラス法による製造プロセス
アルコキシド法
アルコキシド法は、別名Stoeber法といい、ケイ酸アルキル(テトラアルコキシシラン)を塩基性触媒の存在下で加水分解すると同時に縮合・粒子成長を行いながらシリカ粒子を製造する方法です。

Fig10. アルコキシド法によるシリカ一次粒子の生成
Fig11は、ケイ酸アルキルの一種であるテトラメトキシシラン(TMOS)を持ちいた方法です。
原料TMOSに用い純水を加えて加水分解反応をさせます。
このとき、反応液の添加速度の制御が重要で、ゲル化をさせないように一定の流量で少量ずつ添加します。
その後、蒸留によりメタノールを留去した後、pH調整剤を加えて所定のpHに調整します。通常、蒸留後は酸性のため、中性やアルカリ性にpHを調整する場合、pH調整剤としてテトラメチルアンモミウムヒドロキシド(TMAH)が用いられます。TMAHが用いられる理由は、金属元素を含んでいないため、高純度のものが調製できることが理由となります。
pH調整後、還流により濃縮をさせることでコロイダルシリカとなります。

Fig11. アルコキシド法による製法の概略
アルコキシド法によるコロイダルシリカは金属不純物が入るような原材料を用いないため、非常にシリカ純度が高いものとなります。
しかし、テトラメトキシシランのようなケイ酸アルキルは、ケイ酸ソーダに比べて製造工程が複雑です。また、ケイ酸ソーダを用いた工程がより大量生産が可能な反面、金属不純物濃度が高くなるというトレードオフの関係があります。
原料の製造方法
前述のように、ケイ酸ソーダ法にはケイ酸ソーダ、アルコキシド法にはケイ酸アルキルが用いられます。
ケイ酸ソーダ
ケイ酸ソーダは、原料のケイ砂に炭酸ナトリウム(ソーダ灰)を加えた後、1300℃程度で溶融させてガラス(カレット)を作ります。このカレットに水を加えて、高温、高圧下で溶解することでケイ酸ソーダとなります(Fig12)。
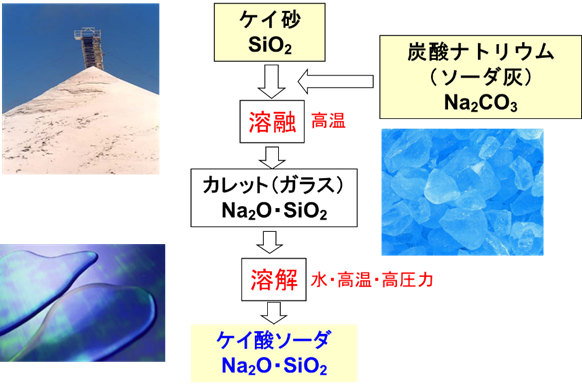
Fig12. ケイ酸ソーダの製法
ケイ酸アルキル
ケイ酸アルキルの製法は、四塩化ケイ素による方法7)と金属ケイ素8)による方法があります。
ケイ酸アルキルはSiの周りにORが4つ結合したもので、このRはアルキル基と呼ばれ、メチル基(‐CH3) 、エチル基(‐C2H5)、プロピル基(‐C3H7)等があり、Rがメチル基(‐CH3)のものはテトラメトキシシラン(TMOS)といいます。
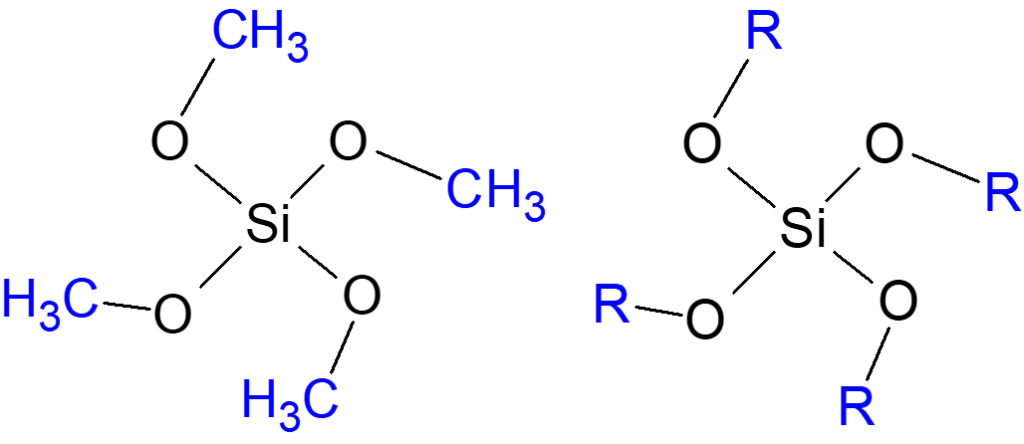
Fig13. ケイ酸アルキルとテトラメトキシシランの構造
四塩化ケイ素を用いる方法
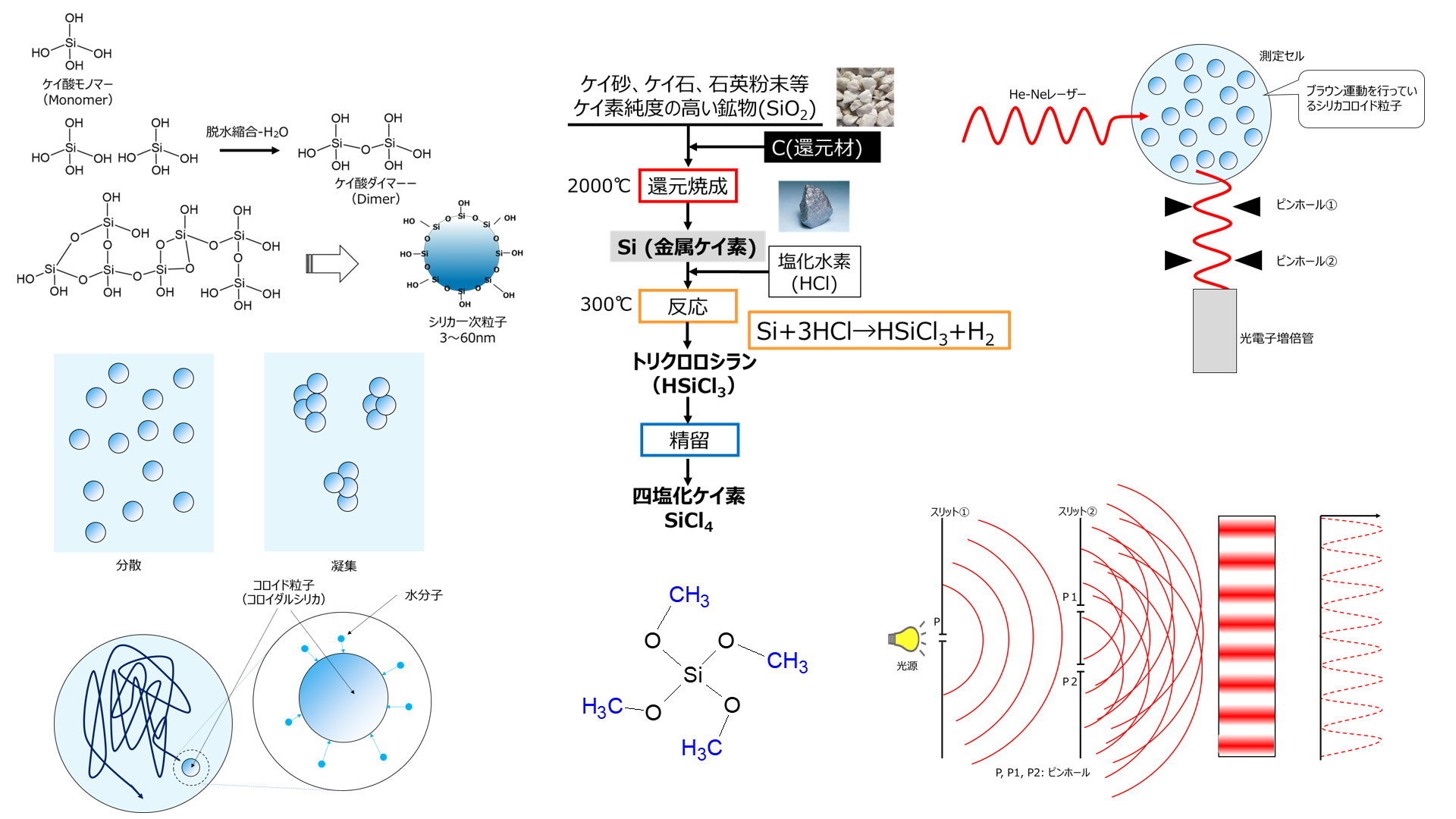
Fig14に四塩化ケイ素の製法を示します。
まず、ケイ砂、ケイ石、石英粉末等のケイ素純度の高い鉱物に還元剤として炭素を加えて2000℃で還元焼成を行うことでシリコン(金属ケイ素)が得られます。
次に、得られた金属ケイ素に塩化水素を加えて300℃で反応させてトリクロロシラン(HSiCl3)が得られます。
このトリクロロシランを精留して四塩化ケイ素が得られます。
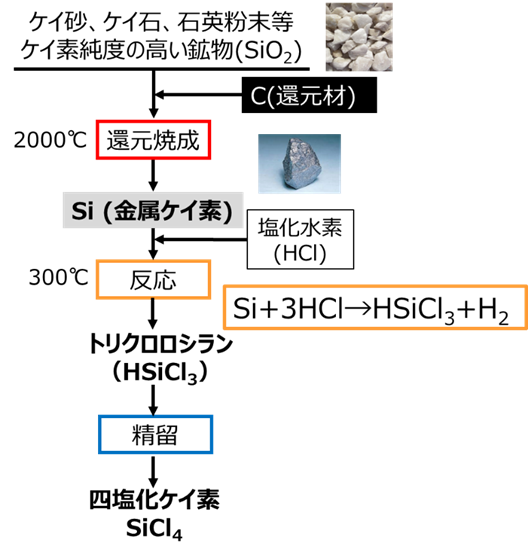
Fig14. 金属ケイ素と四塩化ケイ素の製法
四塩化ケイ素にアルコールを添加して、アルカリ金属アルコキシド触媒を用いて反応することにより、ケイ酸アルキルが得られます。
このとき、副生物として塩化水素が生じますので、これを除きます。
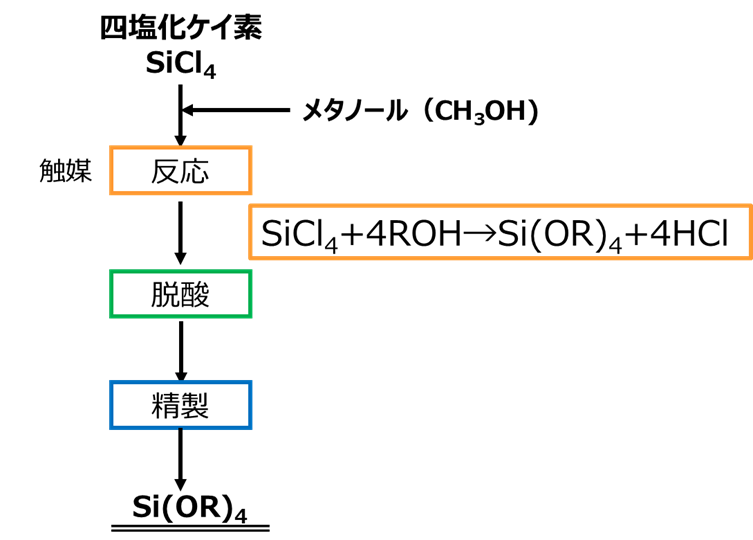
Fig15. 四塩化ケイ素を用いた製法
この方法は、副生する塩化水素とアルコールから生じた水によりケイ酸アルキルの加水分解をしてケイ酸エステルのポリマーが生成するため、この反応を起こさないようにすることが重要です。
金属ケイ素を用いる方法
金属ケイ素にアルコールと触媒を加えて反応させることで、ケイ酸アルキルが得られます。
触媒は、ナトリウムエノラートなどの金属エノラートが用いられます。

Fig16. 金属ケイ素を用いた製法
四塩化ケイ素を用いた反応に比べて全体の製造プロセスが簡単ですが、高温、高圧下で反応を行う必要があります。
粒子径測定方法
コロイダルシリカは粒子径の制御が大切で、粒子径は電子顕微鏡による測定、比表面積から計算で求める(計算法)、動的光散乱等があります。
しかし、非常に小さいナノサイズの粒子径のため、正確に測定するのが難しくどの分析方法に一長一短があります。
電子顕微鏡
フュームドシリカのところで述べた方法と同じで、電子顕微鏡を用いて粒子径を測定する方法となります。
この方法は、試料を調製する際に乾燥させなくてはならず、更にコロイダルシリカは絶縁性のため表面をスパッタリングにより白金等の金属で覆う必要があります。このため、溶液中で存在している状態とは異なります。

Photo2. コロイダルシリカの電子顕微鏡写真9)
計算法
こちらもフュームドシリカで述べた方法と同じで、比表面積から以下の公式を使って粒子径を求める方法ですが、比表面積の測定は乾燥したもの測定しているため、顕微鏡法と同様に溶液中で存在している状態とは異なります。

動的光散乱法(DLS)
動的光散乱法は、別名DLS(Dynamic Light Scattering)法といい。粒子のブラウン運動を利用して粒子径を求める方法です。
ブラウン運動とは、水中でコロイド粒子が不規則に運動する現象です。コロイダルシリカでも起こります。
ブラウン運動は、以下のリンク先の動画で確認できます。
ブラウン運動は、水分子がさまざまな方向からコロイド粒子に不規則に衝突するため、コロイド粒子はあちこちに動かされます(Fig14)
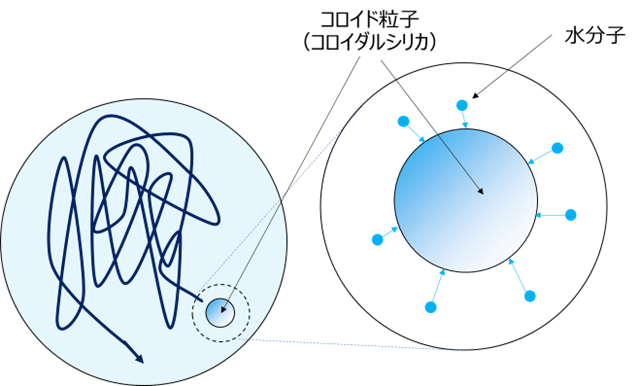
Fig17. コロイド粒子(コロイダルシリカ)のブラウン運動10)
しかし水分子は顕微鏡を用いても小さすぎて見えません。そのため、まるでコロイド粒子自体が動いているように見えます。
懸濁溶液や溶液中に分散した微粒子は、通常ブラウン運動をしており、その動きは大きな粒子では遅く、小さな粒子になるほど早くなります。
この時、ブラウン運動をしている粒子にレーザー光を照射すると、粒子からの散乱光はそれぞれのブラウン運動の速度に対応した揺らぎが観測されます。
動的光散乱法による粒子の測定
動的光散乱法は、溶液中に分散している粒子にレーザー光を照射し、その散乱光を光子検出器で観測して粒子径を算出する方法です。
Fig18に示すようにHe-Neレーザー光がシリカコロイド粒子に照射されると、散乱光が生じその散乱光が検出器(光電子増倍管)で観測されます。

Fig18. 動的散乱法によるシリカコロイド粒子測定イメージ10), 11)
粒子からの散乱光はYoungの光干渉実験モデルのように干渉し合います(Fig19)。
イギリスの物理学者であるThomas Yongは、1905年この実験を用いて光は波であることの証明をしました。
光源から送り出された光は波であるため、スリット①のPの幅が著しく狭いと同心円状に波が拡がり回折します。回折によって波はスリット②のP1、P2にも到達して、ここでも回折が起こり、スクリーンに干渉縞(明暗の縞模様)が生じます。

Fig19. Youngの光干渉実験モデル10),12)
このときシリカコロイド粒子はブラウン運動によりその位置を絶えず移動しているため、散乱光の干渉による強度分布も絶えず揺らぐことになります。
このため、ピンホールや光ファイバー系の光学系をもちいると、このブラウン運動の様子を散乱光強度の揺らぎとして観測することが出来ます。
この揺らぎは粒子径に依存するため、この揺らぎを観測することで粒子径や粒度分布が求められます。
Fig20のように縦軸を散乱強度、横軸を移動時間(時間(t))でプロットすると粒子径の小さい粒子は、短時間で激しく移動するため揺らぎも大きく、粒子径の大きな粒子は緩やかに移動をするため揺らぎは小さくなります。

Fig20. 粒子径と散乱強度(揺らぎ)の関係10)
揺らぎから粒子の大きさを求めるには、粒子光子相関法により自己相関関数を求めます。
自己相関係数から、キュムラント法およびヒストグラム法解析を用いることで、ブラウン運動速度を示す拡散係数を求めることができ、ここから粒子径や粒子径分布が求められます。
以下のリンク先で分かりやすく説明されています。https://www.otsukael.jp/weblearn/chapter/learnid/65/page/3
動的光散乱法を用いた粒子径の測定には
- 比較的短時間で測定できる
- 溶液中に分散しているナノ粒子がそのままで測定できる
- 正確な粒度分布がわかる
等のメリットがあります。
しかし、測定試料自身の粘度や温度などが大きく影響するため、これらの管理が測定には重要となります。
コロイダルシリカの用途
コロイダルシリカはさまざまな用途があり、分散させた粒子を使用するもの、粒子同士を凝集させて使用するものの2つに大きく分けられます。

Fig21. コロイダルシリカの分散と凝集のイメージ
分散による用途
代表的な用途は研磨剤で、40~80nm の大きさのコロイダルシリカは、その粒子の硬さに起因する研磨力を利用して、アルミディスク、ガラス、熱酸化膜基板、シリコンウェハー等の仕上げ研磨に使用されいます。なかでも近年は世界的な半導体需要により、シリコンウェハーの研磨剤用途が急速に伸びています。また、光散乱効果が高いため、化粧品用途としてファンデーションにも用いられています13)。
凝集による用途
コロイダルシリカは凝集による緻密化が容易なため、コンクリート等の建材の硬化剤をはじめ各種硬度強化剤として用いられています14)。なかでも、30nmのコロイダルシリカは透明性が高いため、プラスチックの硬度を向上させるフィラーとして用いられていて、屈折率の低いプラスチックレンズに多く使用されいるとともに薄膜のコート剤にもよく用いられています13)。
また、鋳型の接着にも使用されていて、これまではケイ酸アルキルの一種であるエチルシリケート剤が用いられていたが、固化の際に発生するアルコールが問題視され、コロイダルシリカへの置き換えが進んでいます14)。
更に、シリカ系触媒担体の原料にも用いられており、コロイダルシリカの大きさが30nm以上の粒子は、形成される細孔形状がインクボトル型、それよりも小さい粒子のものはスリット型。更に3nmの以下の場合は、細孔が消滅してしまうということが報告されています13)
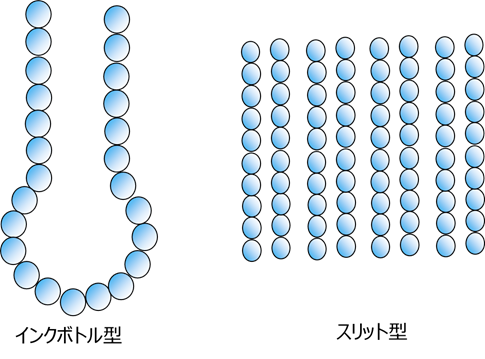
Fig21. インクボトル型とスリット型細孔
これら分散や凝集効果を上げるために溶媒が工夫されたもの。
あるいは、コロイダルシリカ表面シラノール基(Si-OH)を置換させて表面処理を施して親水性、疎水性を向上させたものも上市されています。
おもなメーカー
国内
日産化学株式会社: https://www.nissanchem.co.jp/products/materials/inorganic/products/01/ 扶桑化学工業株式会社: https://fusokk.co.jp/electronicmaterials
海外
Evonik Resource Efficiency GmbH: https://colloidal-silica.evonik.com/en
Nouryon chemicals: https://www.nouryon.com/products/colloidal-silica/colloidal-silica-functions/
Cabot corporation: https://www.cabotcorp.com/solutions/products-plus/fumed-metal-oxides/collodial-and-composite-silicas
Ecolab Inc: https://www.ecolab.com/solutions/construction
WR Grace: https://grace.com/products/ludox/
市場動向
Kenneth Researchは、コロイダルシリカ市場の予測評価を提供する調査レポートを2022年3月 1日 に発刊していて、コロイダルシリカ市場は、2022年に1,046百万米ドル(約1.4兆円)の市場価値から2031年末までに1558.8 百万米ドル(約2.1兆)に達すると予測されていて、世界的に注目されている素材の一つです15)。
コロイダルシリカの安全性
コロイダルシリカは、非晶質シリカの一種です。一般にナノサイズの非晶質シリカは、ミクロン粒子よりもマウスの肝臓に対して強い影響を及ぼすことが示唆されたと報告されていますが、これは血管や腹腔内に直接反復投与した場合なので、現時点ではヒトへの影響は小さいものと考えられています16)。しかし、シリカに限らずナノ粒子の健康影響性は最近になってわかってきたことなので、更に継続した調査が必要です。
このため、経済産業省では、現時点での科学的知見を基にナノマテリアルに関する留意点を整理し、労働現場でのばく露防止対策にとどまらず、事業者による自主的な安全性調査やサプライチェーンにおける情報共有等を含めた広範な安全対策について検討することを目的とするために、平成21年よりナノマテリアル製造事業者等における安全対策のあり方研究会を設けており、シリカを含め6種の物質が評価対象物質として指定されています17)。
これら6種類のものを製造する会社には、ナノマテリアル情報提供シートを経済産業省に提出して、経済産業省は、状況を把握するとともに一般にもWEB上で公開して情報の共有化を図っていて、コロイダルシリカも提出されています18)。
まとめ
コロイダルシリカは、ナノサイズコロイド粒子のシリカが水などの溶媒に分散したもので、工業的にはケイ酸ソーダを用いる方法(水ガラス法)、ケイ酸アルキルを用いる方法(アルコキシド法)に大別され、アルコキシド法によるコロイダルシリカは金属不純物が入るような原材料を用いないため、非常にシリカ純度が高いものとなります。しかし、テトラメトキシシランのようなケイ酸アルキルは、ケイ酸ソーダに比べて製造工程が複雑です。また、ケイ酸ソーダを用いた工程がより大量生産が可能な反面、金属不純物濃度が高くなるというトレードオフの関係があります。
双方ともケイ酸モノマーから脱水縮合により一次粒子が形成され、この一次粒子がコロイダルシリカとなります。このとき、ゲル化をさせないようにするためにpHと電気二重層のコントロールが重要となります。
コロイダルシリカは、単分散のままに使用する方法と、凝集により緻密化させて使用する方法があり、前者は研磨剤や化粧品のファンデーション、後者は建築材料、プラスチックのフィラー、鋳型の接着と幅広い用途があります。このため、1.4兆円以上に市場価値があり、今後の拡大も見込まれています。
現時点では、コロイダルシリカはヒトに対して安全性が高いものと評価されていますが、大きながナノサイズのため、長期暴露による影響等わからないことがあるのが事実です。このため経済産業省は、製造業者からナノマテリアル情報提供シートを通じて、メーカーから情報収集を行い状況を把握するとともに一般にもWEB上で公開して情報の共有化を図っています。
参考文献
1) WR. Grace LUDOX® Colloidal Silica catalog
2) 坂元忠夫の絵画教室 https://qr.paps.jp/0oirW
3)R.K.ILER, The Chemistry of Silica ,p.174 をもとに筆者加筆
4) イビデンエンジニアリング株式会社 https://www.ibieng.co.jp/analysis-solution/g0035/
5) 酸性シリカゾルの製造方法 特許第3463328号 pp. 5-6 (2003)
6) コロイダルシリカの製造方法 特許第5892882号 pp.10-11 (2016)
7) テトラアルコキシシランの製造方法 特開昭62-120390 p. 942 (1981)
8)オルトケイ酸テトラアルキルエステルの製造方法 特開昭55-149290 p. 817(1980)
9)WR. Grace, Brochure of LUDOX ® Colloidal Silica
10) 大塚電子(株)HP https://www.otsukael.jp/weblearn/chapter/learnid/65/page/3
11) 芦澤一英 ナノ粒子に対する動的光散乱法(DLS)による粒子径測定の検討 薬学雑誌 139, p. 241, (2019)
12) 勝田 仁之 再考:ヤングの二重スリット実験 https://www.hs.chuo-u.ac.jp/contents/wp-content/themes/chu-fu/pdf/bulletin/issue31/issue31_pdf06.pdf
13) 小松ら ナノ材料としてのコロイダルシリカの機能と応用 繊維と工業 Vol.60, No.7 p.14 (2014) 14) 井上 浩 精密鋳造の最近の技術動向 鋳造工学 第69巻 第9号 (1997) p.785
15) PRTIMES https://prtimes.jp/main/html/rd/p/000003095.000059861.htm
16) 厚生労働省 リスク評価候補物質選定参考資料⑦-6<シリカ>https://www.mhlw.go.jp/stf/shingi/2r9852000001v7ee-att/2r9852000001v7xl.pdf
17) ナノマテリアル製造事業者等における安全対策のあり方研究会 報告書 平成21年3月 pp.3-9 https://www.meti.go.jp/policy/chemical_management/nanohoukokusho.pdf
18) 日産化学工業 ナノマテリアル情報提供シートhttps://www.meti.go.jp/policy/chemical_management/files/nanomaterial/Silica1_2020.pdf

-300x188.png)

-300x188.png)
-300x188.png)


コメント
コメント一覧 (1件)
[…] 詳細については、記事コロイダルシリカで解説していますので、そちらを参照ください。 […]