はじめに
ケイ酸ソーダ(Na₂SiO₃)は、二酸化ケイ素(SiO₂)と水酸化ナトリウム(NaOH)を高温で反応させて得られる無機化合物で、水溶性のガラス状物質です。別名、水ガラスとも呼ばれ、粘度やモル比(SiO₂/Na₂O)を調整することで、溶液の性質を制御できます。
製造方法
ケイ酸ソーダは、主にFig1で示す方法で製造されています。
ケイ砂(SiO2)に炭酸ナトリウム(ソーダ灰)Na2CO3を加えて1300℃程度で溶融させて、ソーダガラス(カレット)を作ります。このカレットに水を加えて高温、高圧下で溶解をさせて、不純分を濾過しした後に、水で任意の濃度に調製して製品となります。
このとき、原料として使用されるケイ砂は純度99.9%以上のものが用いられます。
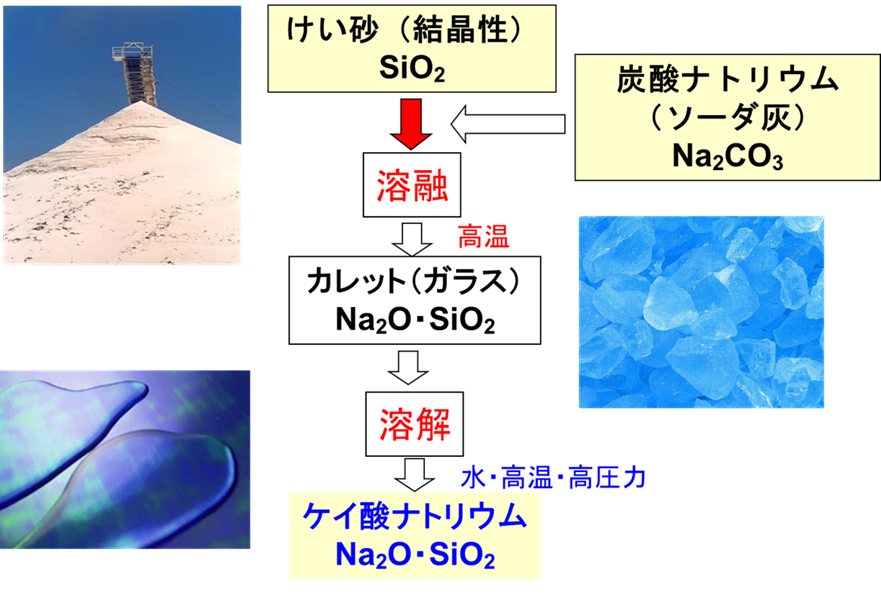
Fig1.ケイ酸ソーダの製造方法
ケイ酸ソーダの規格
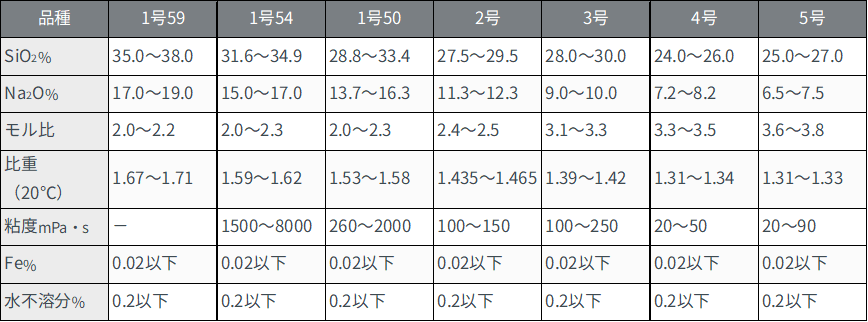
Table1は、ケイ酸ソーダの規格を示したものとなります。
Table1.ケイ酸ソーダの規格値1)

ケイ酸ソーダの外観は、水あめ状の無色ないしわずかに着色した液体です。

Fig2.ケイ酸ソーダの外観2)
試験項目(項目)は、外観、比重、二酸化珪素(SiO2%)、酸化ナトリウム(Na2O%)、不純物量として鉄(Fe%)、水不溶分(%)があり、二酸化珪素(SiO2%)、酸化ナトリウム(Na2O%)量で1号、2号、3号に分類されます。
更に、メーカーによっては、二酸化珪素(SiO2%)、酸化ナトリウム(Na2O%)の比率で詳細に分類している場合もあります。
Table2.規格例3)
ケイ酸ソーダのモル比は、次の式で計算することができます。

また、粉末のものは、メタケイ酸ナトリウムといい、こちらは二酸化珪素(SiO2%)、酸化ナトリウム(Na2O%)の比率で分類され、1 種は5水塩,2種は9水塩となるため、1種の外観は白色粉末または粒状、2種は白色結晶となります。
測定方法
二酸化ケイ素(SiO2%)
試料を熱水に溶かして、塩酸を加えて110~120℃で1時間蒸留乾固し、析出した二酸化ケイ素(SiO2)をろ別します。
炉別したSiO2を約1 000℃で恒量になるまで強熱して重さを量ることでSiO2を定量することができます。
二酸化ケイ素(SiO2%)は以下の式で算出します。
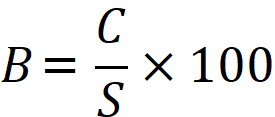
B:二酸化ケイ素(%)
C:残分(g)
S:試料(g)
また、規格法ではありませんが、フッ化水素酸でも測定することが可能です。詳細については、『金属不純物の測定法 ~シリカの前処理~』を参照ください。
酸化ナトリウム(Na2O%)1)
試料を熱水に溶かし,メチルオレンジ指示薬を加え,塩酸で滴定して酸化ナトリウムを定量します。
メチルオレンジによる滴定は、試料を水で希釈した溶液にメチルオレンジ指示薬 1~2 滴を加えて、塩酸(0.1mol/L)で滴定し、溶液の色が黄色から黄赤色となったところを終点として行います。
滴定操作は次の手順で行います。
1)試料2~3g を 1mg の桁まで量り取り、ビーカーに移し入れて熱水を加えて溶かして冷却する。
2)冷却後、全量フラスコ 250mL に移し入れ,水を標線まで加える。これを試料溶液とし、十分に振り混ぜて用いる。
3)試料溶液 25mL をコニカルビーカー200mL に分取し、メチルオレンジ指示薬 1~2 滴を加えて,塩酸(0.1mol/L)で滴定し、溶液の色が黄色から黄赤色となったところを終点とする。
酸化ナトリウム量は、以下の式で算出します。
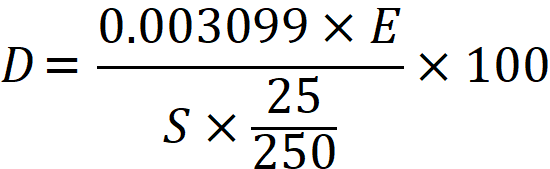
D:酸化ナトリウム%
0.003099:塩酸(0.1mol/L)1mL に対する酸化ナトリウム相当量(g)
E:塩酸(0.1mol/L)塩酸の使用量(mL)
S:試料(g)
三成分系の関係
ケイ酸ソーダは、二酸化ケイ素、酸化ナトリウム、液体なのでプラス水分の量が重要となります。
これら3つの割合により12種類の生成物に分類することができます。
Fig2にNa2O、SiO2、H2O三成分系の相図を示します。
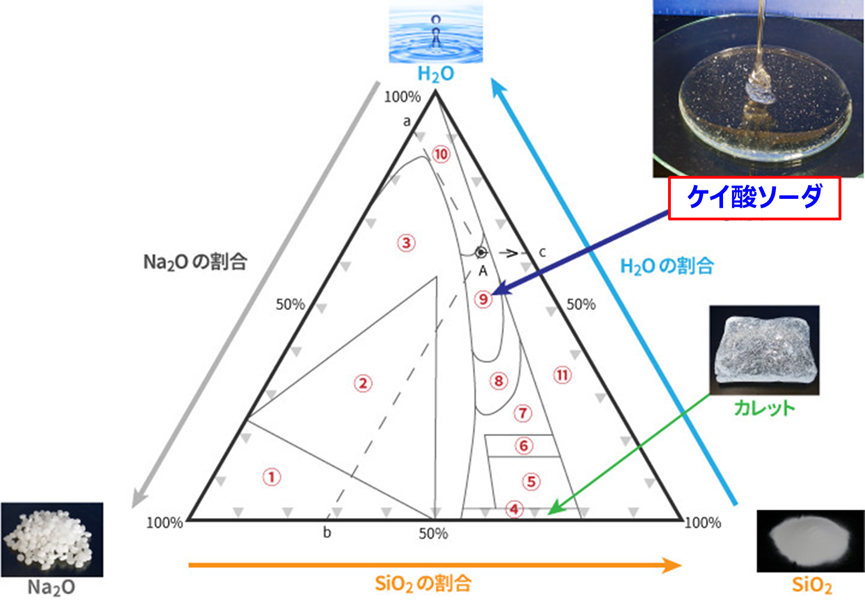
Fig2. Na2O、SiO2、H2O三成分系の相図4)
①:Na2Oの割合が78~100%と高く、SiO2の割合が0~50%、H2Oの割合が0~25%で、この領域では無水オルソ珪酸ソーダと水酸化ナトリウムの混合物が形成されます。
②:Na2Oの割合が25~78%で、SiO2の割合が0~50%、H2Oの割合が0~70%で、この領域ではメタ珪酸ソーダを含む結晶性珪酸ソーダが形成されます。
③:Na2Oの割合が10~100%で、SiO2の割合が0~50%、H2Oの割合が0~90%で、①、②を除いたこの領域では一部結晶性珪酸ソーダを含む混合物が形成されます。
④:ケイ酸ソーダの原料でもあるケイ酸ソーダガラス(カレット)は、SiO2の割合が55~80%、Na2Oの割合が98%程度、H2Oの割合が数%の大変狭い領域で形成されます。
⑤:Na2Oの割合が88~98%で、SiO2の割合が65~80%、H2Oの割合が数~20%で、この領域では水和ガラスが形成されます。
⑥:Na2Oの割合が80~88%で、SiO2の割合が63~80%、H2Oの割合が15~22%で、脱水した珪酸ソーダの領域となります。
⑦:Na2Oの割合が60~98%で、SiO2の割合が55~80%、H2Oの割合が数%~42%の領域から、④、⑤、⑥を除いた領域が半固体珪酸ソーダとなります。
⑧:Na2Oの割合が58~75%で、SiO2の割合が60~70%、H2Oの割合が25~45%の領域で、⑦、⑨を除いた領域が、粘度が高い粘稠珪酸ソーダとなります。
⑨:Na2Oの割合が35~62%で、SiO2の割合が58~65%、H2Oの割合が38~68%の領域で⑧、⑩を除いた領域が、市販のケイ酸ソーダとなります。
A点は3号ケイ酸ソーダで、Na2Oの割合が10%(a点)で、SiO2の割合が28%(b点)、H2Oの割合が62%(C点)となります。
⑩:Na2Oの割合が0~40%で、SiO2の割合が58~62%、H2Oの割合が65~100%の領域で③、⑨を除いた領域が、希薄溶液となります。
⑪:全体から、①~⑩を除いた領域は、不安定な溶液およびゲルが生成する領域となり、SiO2の割合が80%以上の領域で起こりやすくなります。
このように、ケイ酸ソーダは、二酸化ケイ素、酸化ナトリウム、水の割合が非常に狭い領域で生成することがおわかりいただけたかと思います。
ケイ酸ソーダの構造
珪酸ソーダは単一構造ではなく、さまざまな基本構成からなるケイ素(Si)が混在した構造体で、各基本構成の混在比は珪酸ソーダの種類によって異なります。
Fig3に示した29Si-NMRスペクトルの各シグナルは、SiがOを介して結合しているSiの数を表しており、Siが結合していない部分にはNaまたはHが結合しています。
NMRの原理は複雑なので、後日、シリカとNMRというタイトルで別に解説したいと考えています。
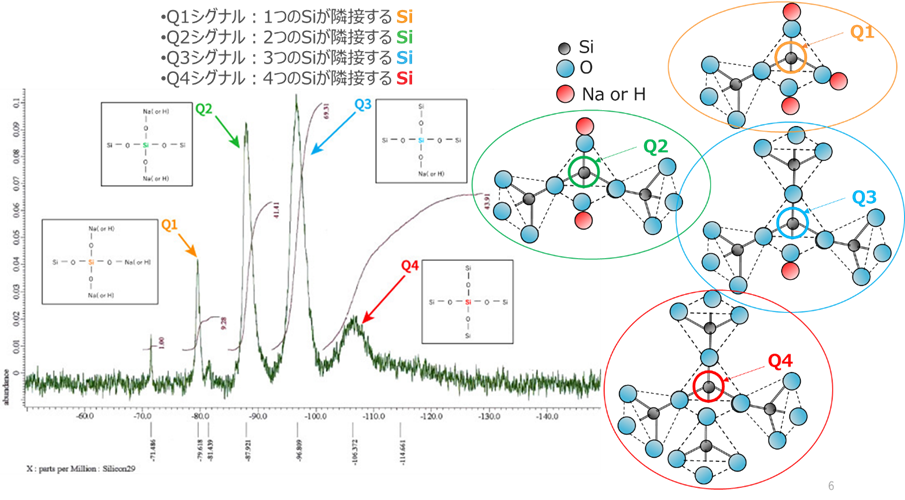
Fig3.ケイ酸ソーダの29Si-NMRスペクトル4)
NMRでは、Siに隣接するSiは4つのパターンに分類することができます。
Q1シグナル:中心のSiにOを介して隣接する Siつまりシロキサン(Si-O-Si)結合が1つ
Q2シグナル:中心のSiにOを介して隣接する Siつまりシロキサン(Si-O-Si)結合が2つ
Q3シグナル:中心のSiにOを介して隣接する Siつまりシロキサン(Si-O-Si)結合が3つ
Q4シグナル:中心のSiにOを介して隣接する Siつまりシロキサン(Si-O-Si)結合が4つ
中心のSiにシロキサン結合の数は、ケイ酸ソーダのゲル化にも大きく影響します。
ゲル化とは、シラノール基のOHが近接のシラノール基のOHと脱水縮合を起こすことで、モノマーからダイマーオリゴマーとなり、環状構造を経て一次粒子となり、この一次粒子の大きさや結合を制御することで。ヒュームドシリカ、シリカゲル、沈降性シリカなどさまざまな合成シリカが作られています。
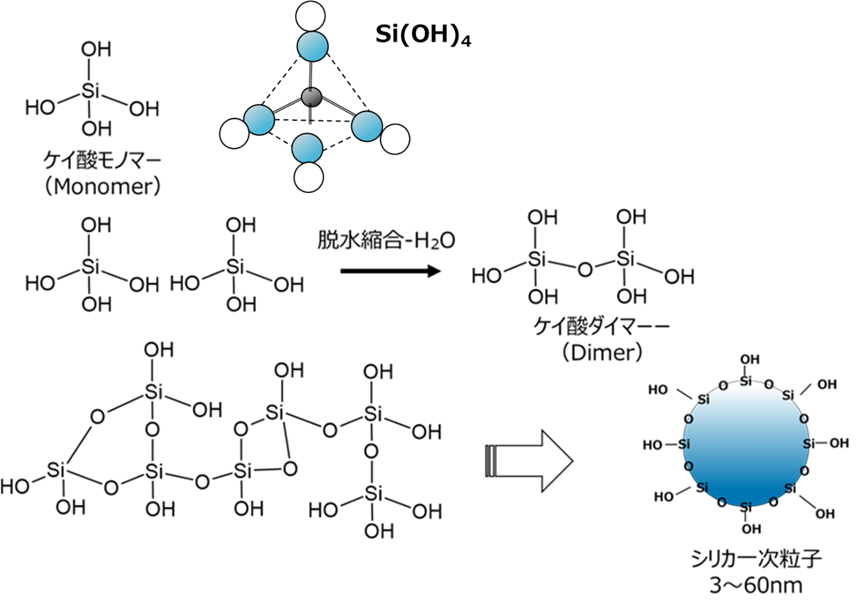
Fig4.ケイ酸モノマーから一次粒子の合成
詳細は、記事『非晶質シリカとその構造』参照ください。
このゲル化は、ケイ酸ソーダの構造も影響します。
モル比3のケイ酸ソーダ(Na2O3.0SiO2)の構造は以下のようになります。
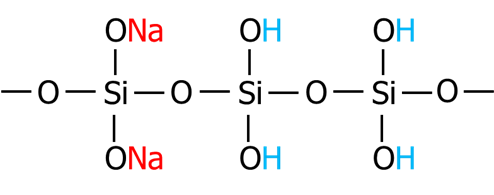
ケイ酸ソーダに塩酸や硫酸を加えることでゲル化は進行します。
例えば硫酸を加えた場合、シリカと硫酸ナトリウムが副産物をして生成します。
Na2O3.0SiO2+H2SO4⇒3.0SiO2+Na2SO4
反応式では一見スムーズに進んでいるように見えますが、実際は、Naは一度Hと交換してシラノール基となり脱水縮合が進むため、シラノール基どうしの脱水縮合に比べて、ONaの部分はゲル化のスピードが遅くなります。
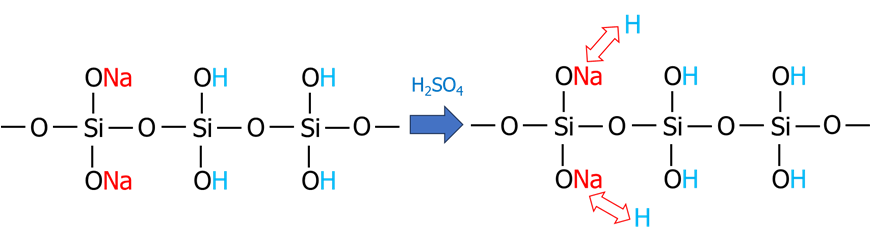
更に、Naの位置で生成する構造が変わります。
モル比3.0のケイ酸ソーダには以下のような6つの異性体構造の存在が考えられ、それぞれの異性体は異なったゲル化のプロセスを示すと考えられます。
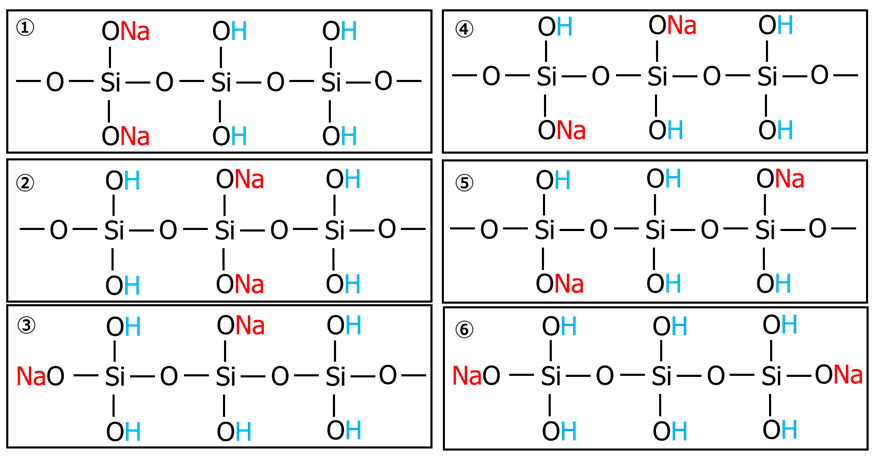
現時点では、これらの構造は制御できませんが、この異性体構造を制御したケイ酸ソーダを作ることができれば、異なる細孔径を有した(バイモーダル)シリカや複雑な構造を有したシリカの調製を、シリコーンのような単位ブロックを組み合わせるように簡単にできるかと筆者は考えます。
シリコーンの構造については、記事『シリコーン』を参照ください。
このようにケイ酸ソーダのゲル化には、Na2OとSiO2のモル比が非常に重要となるため、小数点第1位まで制御される場合があります。
また、Naの位置を制御することで、複雑な構造を有したシリカの調製に寄与できる可能性があります。
更に、温度やpH、塩の存在の存在の有無も重要となります。
一見簡単そうに見えるゲル化ですが、実際は非常に奥が深いことをご理解いただけましたでしょうか?
ケイ酸ソーダの特徴
物理的性質
比重
珪酸ソーダ(水ガラス)は水と任意の割合で混合でき、モル比の調整も可能であるため、目的の物性や特性に見合ったSiO2濃度とNa2O濃度に調整することができます。
珪酸ソーダ(水ガラス)溶液中のSiO2濃度とNa2O濃度の概略値は、Fig5に示した比重とモル比の関係図から求めることができます。
珪酸ソーダ(水ガラス)の比重は通常15℃におけるボーメ度(Be’)で表し、液温t℃におけるBe’値を換算式①に代入することで、Be’(15℃)を求めることができます。
換算式① Be’(15℃)≒Be’+0.04(t℃-15℃)
Be’は、ボーメ計という特殊な比重計を用いてで測定します。

Fig5.重液用比重計(重ボーメ計)5)
また、Be’は比重に換算することができ、Be’(15℃)の値から20℃の比重を求めたい場合には以下の手順で換算することができます。
換算式② Be’(20℃)≒Be’(15℃)+0.04(15℃-20℃)≒Be’(15℃)-0.2
換算式③ 比重(20℃)≒144.3/(144.3-Be’(20℃))
更に、比重はモル比と関係します。
Fig6に比重とモル比の関係を示します。
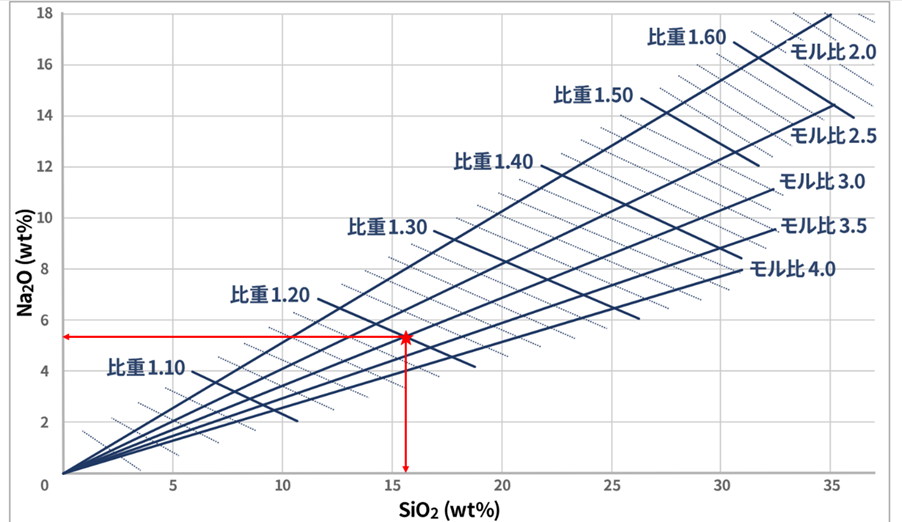
Fig6.比重とモル比の関係6)
Na2O、SiO2の量が増えると比重は上昇する傾向があります。
比重とモル比がわかれば、例えば、そこからNa2O量とSiO2量(ともにwt%)を求めることができます。
例えば、比重1.20、モル比3.0のケイ酸ソーダは、Na2O 5.5wt%、SiO2 15.5wt%となります。
pH
ケイ酸ソーダはアルカリ性の溶液で、pH値はNa2O濃度とモル比によって変化します。
また、同じNa2O濃度であってもモル比が高い珪酸ソーダほどpH値は低くなる傾向を示します。これはSiO2、つまりシラノール基の緩衝作用によるもので、特徴の一つとなります。
Fig7にNaOH量とケイ酸ソーダのpHの関係を示します。
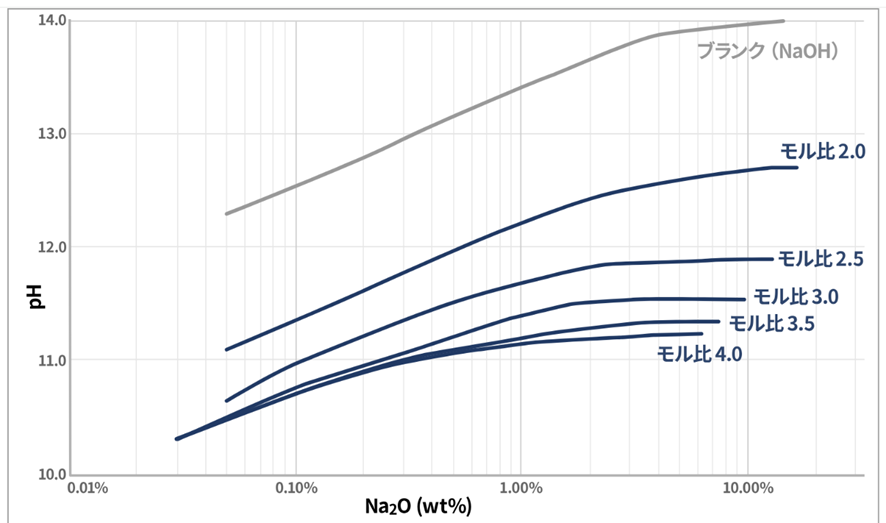
Fig7.NaOH量とケイ酸ソーダのpHの関係6)
粘度
ケイ酸ソーダの粘度は、比重(濃度)、モル比、温度によって著しく変化するので、取り扱いに注意が必要です。
粘度とシリカ(SiO₂)と酸化ナトリウム(Na₂O)のモル比の関係は次のようになります。
シリカのモル比が高い(SiO₂が多い)ほど:粘度が高くなる
シリカモル比が低い(Na₂Oが多い)ほど:粘度が低くなる
これは、ケイ酸ソーダの構造の重合度が関係してきます。
モル比が高い場合は、SiO₂が多いため、先に説明したようにシラノール基(Si-OH)が増えます。シラノール基は水素結合により互いに引き合うため脱水縮合により、シロキサン結合となり、高分子状のケイ酸ネットワーク(鎖状・網状構造)が形成されやすくなるためで、結果として液体の粘度が上がります。
逆にモル比が低い場合は、Na₂Oが多いため、Na⁺イオンがケイ酸の重合を中断しやすく、低分子量のケイ酸イオン(例:モノケイ酸、ジケイ酸)が主体になるため結果として粘度が下がります。
粘度と比重の関係
Fig8に20℃におけるケイ酸ソーダの粘度と比重の関係を示します。
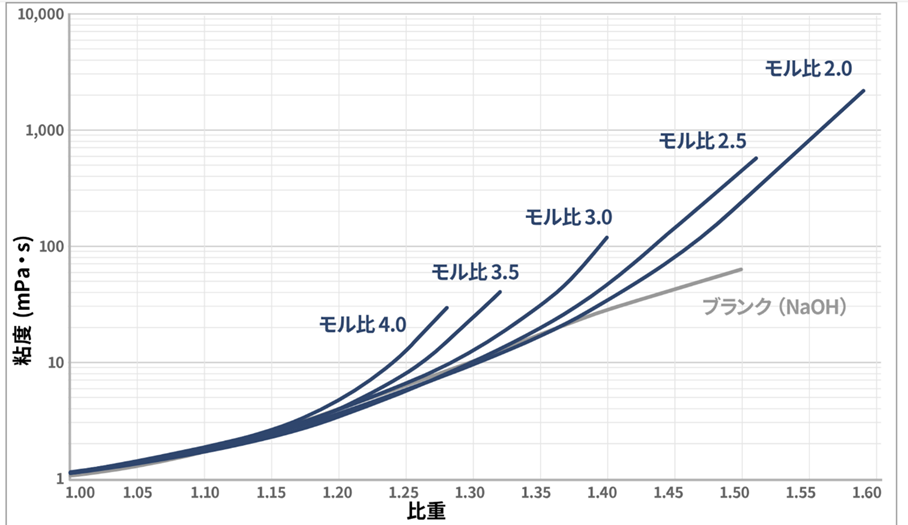
Fig8.ケイ酸ソーダの粘度と比重の関係(20℃)6)
モル比が一定の場合、ケイ酸ソーダの比重(濃度)が高い程、粘度は高くなります。
一方、比重(濃度)が一定の場合は、ケイ酸ソーダのモル比が高くなるほど粘度も高くなります。
粘度と温度の関係
粘度と温度の関係はFig9で示すようになります。
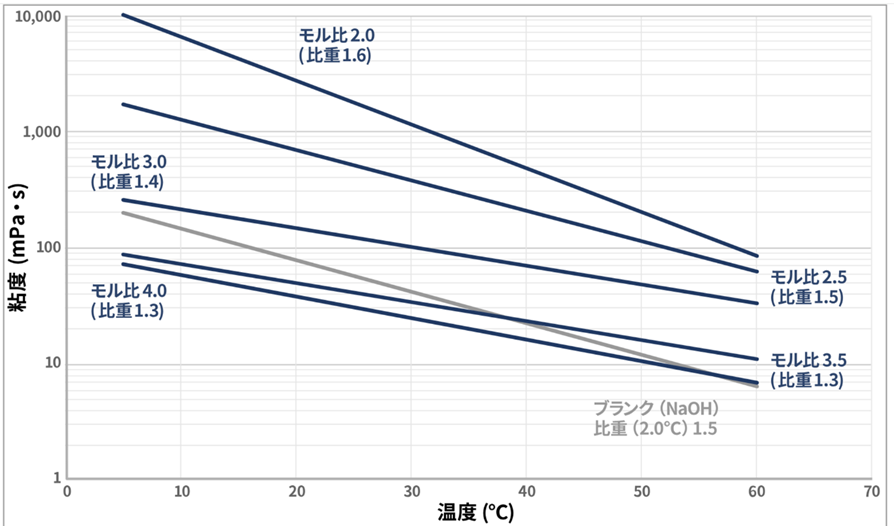
Fig8.ケイ酸ソーダの粘度と温度の関係6)
ケイ酸ソーダの粘度と温度の関係は、一般の液体と同様に温度が上がると粘度は下がるという傾向がありますが、水分含有率やSiO₂/Na₂Oモル比によって変化の度合いが大きいのが特徴です。
これはケイ酸ソーダ構造中のケイ酸塩の運動性が増すことと、水の粘性抵抗が低下するためです。
ケイ酸ソーダの粘度変化はアレニウス型挙動(Arrhenius-type behavior)または対数線形モデルで近似できます:
μ(T)=μ0⋅exp(EaRT)\mu(T) = \mu_0 \cdot \exp\left(\frac{E_a}{RT}\right)μ(T)=μ0⋅exp(RTEa)
- μ(T)\mu(T)μ(T):温度Tにおける粘度
- EaE_aEa:活性化エネルギー(粘度減少のしにくさ)
- RRR:気体定数
- TTT:絶対温度(K)
- μ0\mu_0μ0:理想的な初期粘度
凝固点降下と氷結点
珪酸ソーダ(水ガラス)の氷結点は水より低く、モル比や比重によって異なります。3号珪酸ソーダの氷結点は-3~-5℃程度ですが、1号珪酸ソーダ相当品では比重が著しく高いため-7~-9℃になっても氷結せず粘性が増大するだけです。珪酸ソーダの氷結の形状は斜方結晶で、温めると元の溶液に戻ります。
この現象は凝固点降下によるものです。
「凝固点降下」とは、溶質が溶媒に溶けることで溶液の凝固点(凍る温度)が下がる現象のことです。これはコラド性質(colligative properties)の一つで、溶質の種類ではなく粒子数(濃度)に依存します。
溶液の凝固点は、純粋な溶媒よりも低くなる。この凝固点の低下量を凝固点降下と呼び、その現象全体を「凝固点効果」といいます。
凍結防止剤は、凝固点効果を利用して水の凍る温度(凝固点)を下げ、凍結を防ぐ薬剤です。
溶質(例:塩、エチレングリコールなど)を水に溶かすと、水の分子が結晶になりにくくなり、凍結にはより低い温度が必要になります。これにより、道路や機械の配管内での凍結を防止できます。
比熱
比熱(specific heat)とは、**物質1gあたりの温度を1℃上げるのに必要な熱量(エネルギー)のことです。単位は通常:
J/g\cdotp℃(または cal/g\cdotp℃)
現在市販されている珪酸ソーダ(水ガラス)の比熱は、0.7~0.9Kcal/kg(25℃)程度で、以下の傾向を示します。
モル比が一定の場合:珪酸ソーダ(水ガラス)の濃度が高い程、比熱は小さくなる。
濃度が一定の場合:モル比が高い珪酸ソーダ(水ガラス)程、比熱は小さくなる。
化学的性質
珪酸ソーダは酸、無機塩類、有機化合物、炭酸ガスなどと反応し、固化し、この固化をゲル化と呼び、化学的性質を解説する上で重要なポイントとなります。
酸によるゲル化
先に示したように珪酸ソーダ(水ガラス)は、珪酸より強い全ての酸との反応によってpH値が変化し珪酸を遊離します。
計算ソーダの構造で解説をしたように、遊離した珪酸は、珪酸同士の脱水と重合が進行し、ただちに粒状に沈殿する場合や数分~数日かけて寒天状に固まる場合など、さまざまな速度でゲル化します。このときに生成したゲルを「ケイ酸ゲル(シリカゲル)」といいます。
シリカゲルとゲル化については、記事『シリカゲル』を参照ください。
ケイ酸ゲルの生成速度(ゲル化時間)は、ケイ酸ソーダと酸の混合液におけるSiO2濃度やpH値によって著しく変化します。
ケイ酸ゲルの生成速度(ゲル化時間)には次のような傾向があります。
混合液のSiO2濃度が高い程、ゲル化時間は速くなります。
混合液のpH値が中性付近で、ゲル化時間は速くなります。
中性付近がゲル化時間が最も早く、混合液のpH値が酸性またはアルカリ性に変動する程、ゲル化時間は伸びます。
Fig9にケイ酸ソーダの粘度と温度の関係を示します。
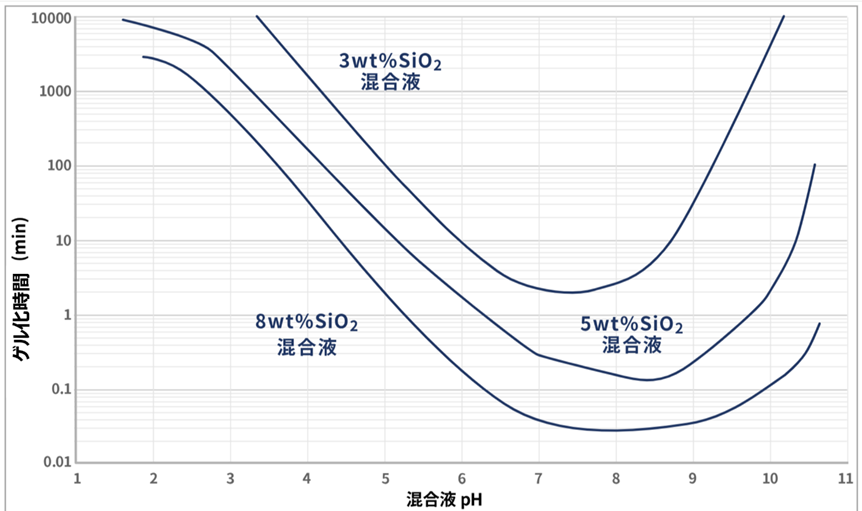
Fig10.ケイ酸ソーダの粘度と温度の関係7)
無機塩類によるゲル化
ケイ酸ソーダは無機塩類でもゲル化ができます。
ケイ酸ソーダは、Ca、Mg、Al、Baなどの無機塩類と反応して、不溶性のケイ酸塩金属水和物やケイ酸などを同時に生成してゲル化します。
例)水酸カルシウムとの反応
Na2O・nSiO2・mH2O + Ca(OH)2 → CaO・nSiO2・2NaOH・mH2O (一部、SiO2になります)
このような反応で得られるケイ酸化合物は、ケイ酸と金属イオンの存在量に応じてさまざまな特性を示します。
有機化合物との反応
多価アルコール(グリオキザールなど)や酢酸エステルは、ともにアルカリ存在下で酸を生成するため、ケイ酸ソーダとの反応により「ケイ酸ゲル」を生成します。
例)グリオキザールとの反応
(CHO)2 + H2O → CH2OH・COOH (グリオキザールがグリコール酸になります。)
Na2O・nSiO2・mH2O + 2CH2OH・COOH → nSiO2 + 2CH2OH・COONa + (m+1)H2O
エチルアルコールなどの有機溶媒を加えても固化しますが、これは単なる脱水によるもので、水を加えると再び溶解します。
炭酸ガスとの反応
ケイ酸ソーダ(水ガラス)に炭酸ガス(CO2)を吹き込むことで、下記反応により「ケイ酸ゲル」を生成します。ケイ酸ソーダの水分を吸収する砂などとともに反応を進行させることで飛躍的に硬度が上がります。
Na2O・nSiO2・mH2O + CO2→ nSiO2 + Na2CO3 + mH2O
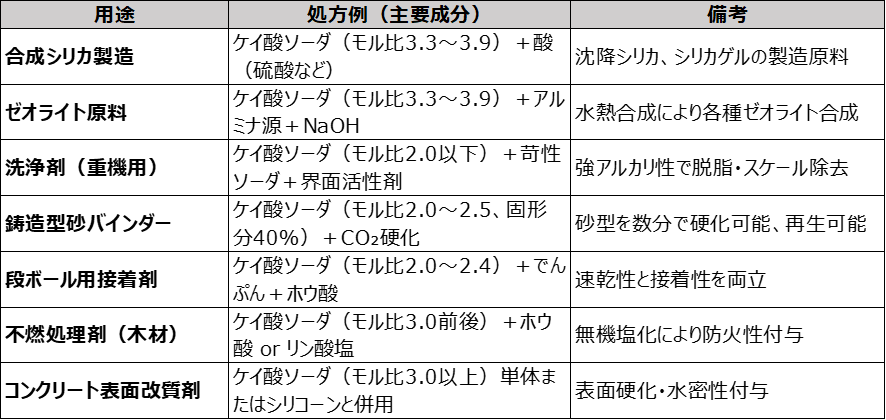
用途
ケイ酸ソーダは、多様な産業分野で使用される汎用無機材料で、接着・分散・バインダー・アルカリ源としての機能を持ちます。以下に主な用途について解説します。
土木業界
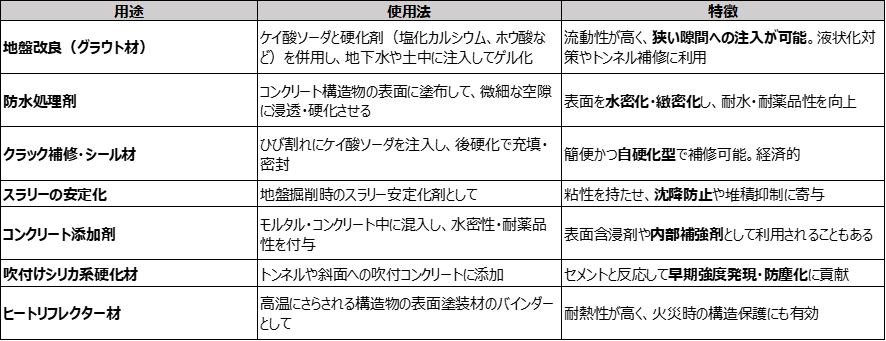
ケイ酸ソーダには次のような特長があることから、地盤カ改良剤(クラウト剤)や防水処理剤をはじめさまざまな土木用途に使用されています。
粘度調整性:浸透・注入用途で流動性を最適化可能
自己硬化性:硬化剤添加で可制御なため地中・コンクリート内で安定なゲル形成
無機系・不燃:長期耐久性が高く、防火・耐薬品性に優れる
シリカ骨格の形成:堅牢性の高い補強構造を内部に作ることができる
Table3.土木業界における主な用途
実際は、以下のようなところで使用されています。
地盤沈下防止工事(薬液注入工法)
トンネル漏水止め(ケイ酸ナトリウム系止水剤)
コンクリート橋脚の表面改質(緻密化・耐塩害性向上)
コンクリート床版の耐久補強(塗布型シランシロキサン併用)
ケイ酸ソーダは、古くからトンネル内のトンネル漏水止めに使用8)され、現在も使用されている薬剤の一つで、ほぼすべてのトンネルの漏水対策に使用されているといっても過言ではありません。
現在進行中のリニア中央新幹線の工事にも不可欠な材料の一つとして位置付けられています。
また、東日本大震災による福島第一原発からの放射能汚染水流出の食い止めにもケイ酸ソーダが活躍しました。9)
ケイ酸ソーダは、土木用途の他に、合成シリカやゼオライト等の原料、清浄剤、接着剤・バインダー、防火・耐火材、水処理剤等さまざまな用途に用いられています。
合成シリカ・ゼオライト原料:水熱合成によるゼオライト、沈降シリカ、シリカゲルの原料
洗浄剤(洗剤): アルカリ性を利用し、油脂や汚れの分解・乳化に使用されます。特に油汚れの工業用洗剤に使用されています。
接着剤・バインダー:ダンボール、紙管、鋳造型砂、耐火レンガの接着・成形用バインダー
防火・耐火材:繊維や木材への難燃処理剤として使用(不燃化)
鋳造用バインダー:鋳型の砂を固める無機バインダーとして(CO₂硬化法)
コンクリート添加剤:水密性向上・耐アルカリ性付与・表面保護コート材として利用
水処理剤:スケール防止、重金属沈殿補助、pH調整剤として使用
漂白安定剤:過炭酸塩や過硫酸塩の安定化に使用(漂白剤用補助剤)
溶接棒・電極のコーティング剤:溶融バインダーとして使用し、スラグ形成やアーク安定に寄与
鉱石浮選剤: 鉱石の表面改質により選鉱効率を改善(鉄鉱石など)
Table4に用途毎の処方例をまとめておきます。
また、ケイ酸ソーダはモル比によって大幅に特性が変わるため、モル比によって使い分けられる場合があります。
Table5にモル比(SiO₂/Na₂O)と用途の関係をまとめておきます。
Table5.モル比(SiO₂/Na₂O)と用途の関係

まとめ
ケイ酸ソーダは、Na2OとSiO2と水(H2O)で構成されている強アルカリ性の液体で、Na2Oのモル量をSiO2のモル量で除したものをモル比といい、モル比がケイ酸ソーダの性質(粘度、pH、氷結点)を決めていると言っても過言ではありません。
ケイ酸ソーダは、合成シリカ合成で使用される酸との反応の他に、無機塩類、アルコールやエステルなどの有機化合物とも反応してゲル化します。
私は、合成シリカの専門家なので、合成シリカ原料に注目しがちですが、実は古くから土木工事には欠かせない材料で、地盤カ改良剤(クラウト剤)や防水処理剤をはじめさまざまな土木用途に使用されていて、現在進行中のリニア中央新幹線の工事や、東日本大震災による福島第一原発からの放射能汚染水流出の食い止めにもケイ酸ソーダが活躍しました。
更にケイ酸ソーダは、合成シリカやゼオライト等の原料、清浄剤、接着剤・バインダー、防火・耐火材、水処理剤等さまざまな用途に用いられています。
参考文献
1)JISK1408ケイ酸ナトリウム(ケイ酸ソーダ)規格一覧(2022年4月1日より日本無機協会規格に移行)
2) 富士化学株式会社https://www.fuji-chemical.com/products/silicic_acid/
3)富士化学株式会社ケイ酸ソーダカタログ
4)東曹産業株式会社https://www.toso-sangyo.com/products/about/
5)安藤計器株式会社https://www.andokeiki.co.jp/hizyuukei/10zyuubo-me.html
6)東曹産業株式会社https://www.toso-sangyo.com/products/properties/
7)東曹産業株式会社https://www.toso-sangyo.com/products/characteristic/
8)薬液注入工法による建設工事の施工による暫定指針 昭和49年7月10日 建設省官技発第160号
9)福島第一原子力発電所での事故による放射性物質放出の海洋への影響 日本海洋学会 2011 年5月13日

-1.png)



-300x188.png)
-300x188.png)
-300x188.png)
-300x188.png)

コメント