はじめに
シリカを構造で分けた場合、結晶性と非晶質に大きく分けられ、同じシリカでも似て非なるものです。
結晶性シリカと非晶質シリカはどちらもさまざまな分野で使用されていて、みなさんの生活にはなくてはならない材料です。前回の記事『結晶性シリカ』では、天然の結晶性シリカは、火山噴火により地表に噴出したマグマ(溶岩)が冷却されることにより作られ、地球上に多くの種類の結晶性シリカが存在する理由の一つとして解説しました。非晶質シリカは、この結晶性シリカを分子レベルまでをばらばらして、再度組み立てられたもので、分子の配列に規則性がないものが非晶質シリカです。非晶質シリカは、珪藻土、シリカゲル、沈降性シリカなどのゲル法シリカ、フュームドシリカ、多孔質ガラス等があり、それぞれの構造は特異的です。
今回は、非晶質シリカの種類とその特異的な細孔の構造について解説していきます。
非晶質(Non-Crystalline Solids)とは
粒子が規則的に配列していない固体は「非晶質」と呼ばれています。代表的なものでは、ガラスやゴムが挙げられます。ガラスの分子構造は、ケイ素原子(赤丸)と酸素原子(水色丸)からなり、構造がばらばらで規則性がないのが特徴です。非晶質は、別名アモルファス(Amorphous)とも呼ばれています。

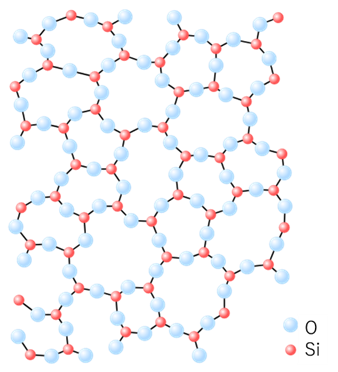
Fig1. ガラス1)とその分子構造 2)


Fig2. ゴム3)とその分子構造
ゴムは、ゴム材料は網目構造になっており、網目が交差している点を架橋点といい、網目自体は自由に動くことができますが、架橋点によって拘束されています。この網目と架橋点によって、伸びたり縮んだりするゴムとしての特性が生まれます。
XRDでの評価
X線回折法(X-ray Diffraction:(XRD)) を用いることで、結晶性シリカのようなセラミックス結晶や金属結晶のような結晶性物質はピークを示します。結晶性の物質は、それぞれ特有な規則性を持つ結晶を作ることができることでその有無が判別でき、ここから化合物の種類を調べることもできます。
また、非晶質の物質はピークを示しませんので、ここから非晶質物質であることの確認もできます。
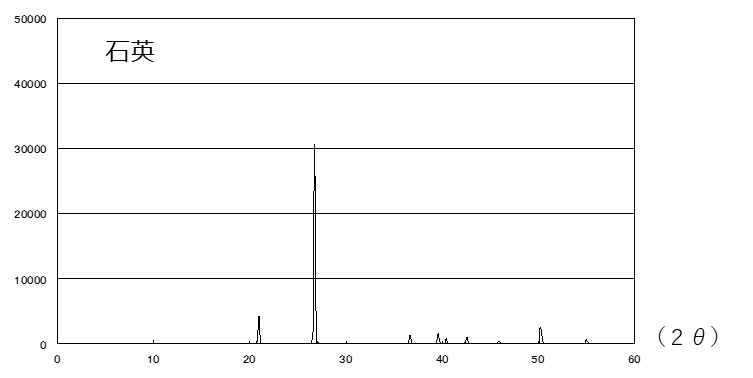

Fig3. 石英とシリカゲルのXRDチャート
Fig3に石英とシリカゲルのXRDチャートを示します。石英は結晶性であるため、横軸の目盛りの読み取り値(2θ)の数か所からピークが出ていることがわかります。一方シリカゲルは、非晶質のためピークは現れずハローパターンを示します。
非晶質シリカとは
分子の配列に規則性がないものが非晶質シリカです。非晶質シリカは、シリカゲル、沈降性シリカなどのゲル法シリカ、フュームドシリカ、多孔質ガラス等があり、珪藻土(未焼成)も非晶質シリカの仲間です。
更に、みなさんの周りで最も身近なガラスも非晶質シリカに分類されます。
Fig4に石英とガラスの分子構造について示します。石英は結晶性シリカのため、分子が規則的に並でいる構造を取っています。一方、ガラスは、分子が不規則に並んでいることがわかります。
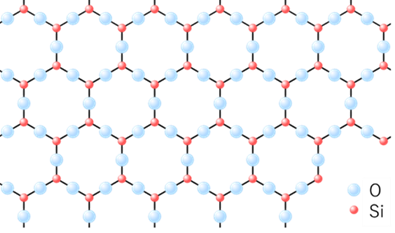
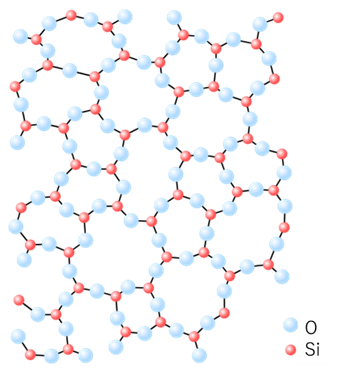
Fig4. 石英4)とガラス2)の結晶構造
石英は、ケイ素原子(赤丸)と酸素原子(水色丸)からなる6角形の構造の繰り返しにより結晶を形成しています。一方ガラスは、ケイ素原子(赤丸)と酸素原子(水色丸)からなり、構造がばらばらで規則性がありません。
非晶質シリカの種類
非晶質シリカは、製法別に珪藻土、シリカゲルのようなゾルゲル法シリカ、沈降性シリカ、フュームドシリカ、多孔質ガラスに分類できます。
珪藻土は天然由来の非晶質シリカで、珪藻土は、珪藻(ケイソウ)と呼ばれる藻が化石化したものです。工業的にシリカゲルや沈降性シリカは、天然で結晶性シリカである珪砂を原料にケイ酸ソーダを経て作られ、これら製法を湿式法といいます。また、フュームドシリカは、珪砂等の結晶性シリカをから作られた四塩化ケイ素を原料に作られ、この方法は乾式法と呼ばれています。多孔質ガラスは、珪砂にホウ砂、ソーダ灰を溶融することで作られ分相法といいます。
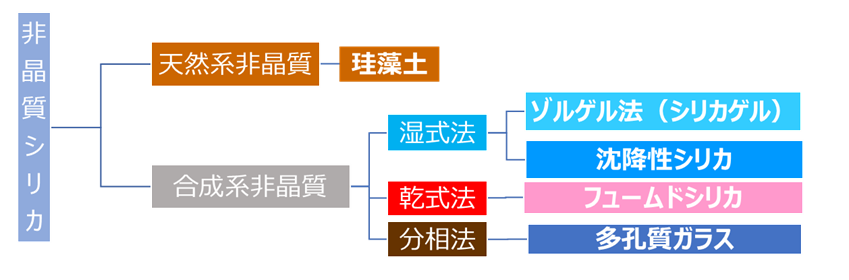
Fig5. 非晶質シリカの製法別分類
珪藻土を除くこれら非晶質シリカは、一旦結晶質シリカの構造が、熱などにより分子レベルまでばらばらにされ、再度構築されることで得られます。この再構築されるときに構造を制御するため、非晶質シリカには多くの種類のものがあります。また、分子レベルまでばらばらにされるため、たくさんのエネルギーが必要となります。
Fig6にケイ酸ソーダの製法と分子構造を示します。ケイ酸ソーダ(ケイ酸ナトリウム)は、シリカゲルや、結晶性シリカの原料となります。ケイ酸ソーダは、結晶性シリカであるケイ素に炭酸ナトリウム(ソーダ灰)を加え、1000℃以上の高い温度で溶かします。この工程を溶融といいます。これを冷却して固めたものをカレットといい、ガラスの一種となり、ソーダガラスもこの方法で作られます。このとき、構造はガラス化により、結晶質から非晶質になります。
このカレットに水を加え、高温、高圧力で溶解させることで分子単位にバラバラになります。実際は、オルトケイ酸ナトリウムやメタケイ酸ナトリウムのような構造を取りNa2OとSiO2の割合(モル比)により物性をコントロールしたさまざまな種類のケイ酸ソーダが販売されています。
このケイ酸ソーダに硫酸など用いて反応させることでシリカゲルや沈降性シリカが作られ、非晶質構造となります。
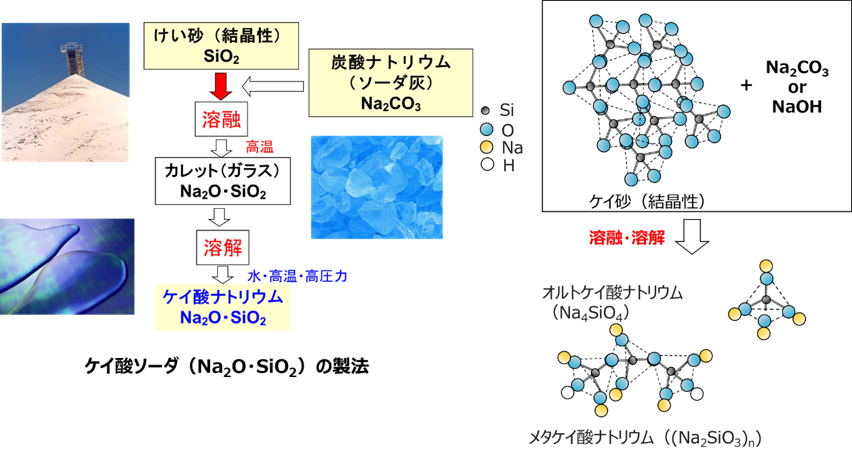
Fig6. ケイ酸ソーダの製法と分子構造
珪藻土
珪藻土(diatomite、diatomaceousearth)
珪藻土は、珪藻(ケイソウ)と呼ばれる藻が化石化したもので、次のような特徴があります。たくさんの孔がある多孔質体で、形状は珪藻の骨格に依存するため、さまざまなタイプがあります。
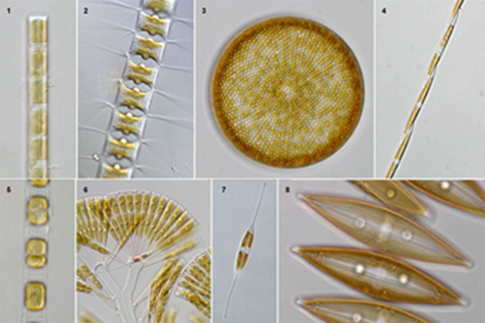
Photo1.珪藻の顕微鏡写真5)
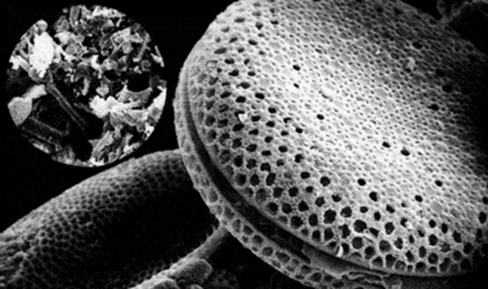
Photo2. 珪藻土の電子顕微鏡写真6)
製法
工業材料としての珪藻土は製法により、乾燥品、焼成品、融剤焼成品の3つに大別されます。
Fig7に製造フロー図を示します。採掘された珪藻土の原鉱は、粉砕、乾燥、粒度調整(分級)の各工程を経て乾燥品となります。この乾燥品を焼成して、粉砕、乾燥、粒度調整(分級)の各工程を経ることで焼成品となり、炭酸ナトリウム等の融剤を焼成前に加えたものが融剤焼成品となります。
また、これら製品の表面の金属を除去するために酸処理を行ったものもあります。
採掘時は50~80%の水分を含んでいて長距離の搬送はコストが上がってしまうため、生産工場は鉱区に隣接しているケースが多いのが特徴の一つです。
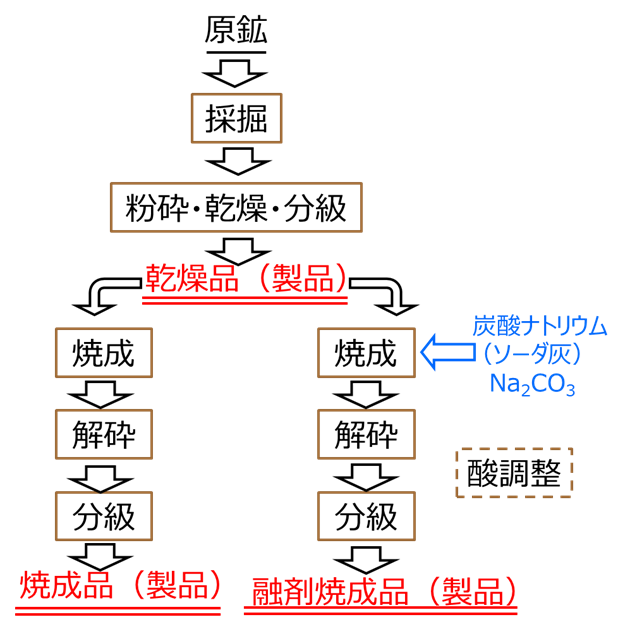
Fig.7 製造フロー図
種類と用途
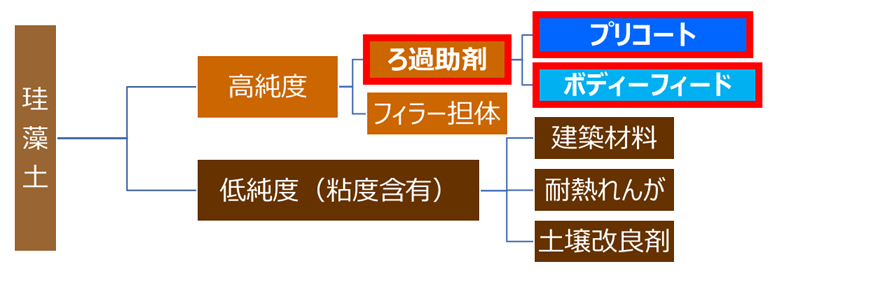
Fig8. 珪藻土の種類と用途
Fig8のように珪藻土は、粘度成分含有の有無で高純度品、低純度品に分けられます。
高純度化された珪藻土は、主にろ過助剤として用いられる他、アンチブロッキング剤や、プラスチック等のフィラー担体にも用いられています。一方、低純度品につきましては、建築材料、耐熱れんが、土壌改良剤等に用いられています。
ゾル・ゲル法シリカ
コロイド粒子とゾル
コロイドとは、ある物質が直径2~500nm程度の微粒子や液滴となって、別の物質中に分散している状態で、ゾルとは、これら微小なコロイド粒子と溶媒の混合物を指します(Fig9)
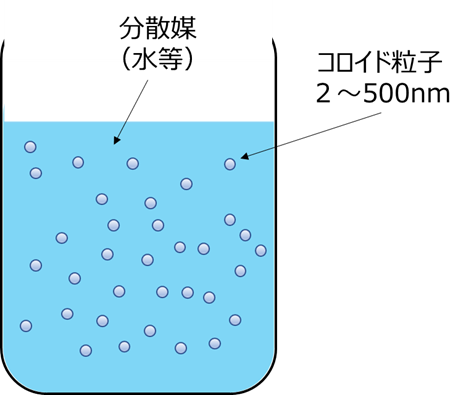
Fig9. コロイド粒子のイメージ
コロイダルシリカ
コロイダルシリカは、ケイ酸モノマーから脱水縮合によりケイ酸ダイマーからオリゴマーを経て形成された球状粒子が、水等に分散しているものとなります。

Fig10. シリカコロイド粒子の構成
コロイダルシリカは、文字通りシリカコロイド粒子が水等の溶媒に分散したもので、コロイドの粒子径により透明度が異なります。これは、光が光の波長よりも粒径の小さい粒子にぶつかったときに起こるレイリー散乱によるもので、粒子径が大きくなるほど散乱強度が強くなるために、肉眼では白色が強くかつ濁りが強くなっているように見えます。

Photo3. さまざまなコロイダルシリカ7)
ゲル
上述したコロイド溶液 (ゾル) が流動性を失ってゼリー状となったものです。ゲルは、みなさんの周にもたくさんあり、プリン、寒天,豆腐,こんにゃくもゲルの仲間になります。

ゾル・ゲル法
文字通りゾルをゲル化させる方法で、ゲルとは、個体と液体の中間に分類されます。ゾル・ゲル法は溶液から出発して材料をつくる合成法で、シリカゲルのような多孔質ゲルをはじめ、有機無機ハイブリッド材料、ガラス、セラミックス、ナノコンポジット等の製造に用いられています。
例えば、シリカゲルは、アルカリであるケイ酸ソーダと硫酸の中和反応で作られます。

Fig11. シリカゲルの反応式
簡単に言うと、ケイ素には手が4本、酸素には手が2本あり、Si-O-Siのネットワークが形成され、Fig8で示したように、コロイダルシリカと同様に、ケイ酸モノマーから脱水縮合によりケイ酸ダイマーからオリゴマーを経て球状粒子が形成されます。この球状粒子が水中等に単分散しているものをコロイダルシリカ、球状粒子同士がくっついて集合体を形成しているものゲルといい。このゲル化が最も顕著なタイプのシリカをシリカゲルと呼びます。乾燥前のシリカゲルをシリカヒドロゲルといい、固めのゼリーのような感じです。

Fig12. シリカネットワークの形成とゲル化のイメージ
ゲル化のルール
Fig13で示すようにシリカのゲル化にはルールがあります。
コロイダルシリカのところで説明しましたように、ケイ酸モノマー(一量体)は、脱水縮合により二量体から四量体のようなオリゴマー、環状を経て球状粒子となりこれ一次粒子と呼びます。このときpHを7以下、または塩化ナトリウムのような金属塩の存在下でpHを7-10に調整したものは、一次粒子径が小さいままで集合体を形成します(反応経路A)。一方、pHを7-10に調整したものは、一次粒子単独で成長する方向で反応が進みます(反応経路B)。
このとき、単分散の粒子で存在するものをコロイダルシリカとなります。また、一次粒子の大きさ、粒子の結合度合いから、シリカゲル、沈降性シリカ、フュームドシリカに分離され、これらシリカは広義的にはゲル化が大きく関わっています。中でもシリカゲルはこの構造が発達したものに位置付けられます。
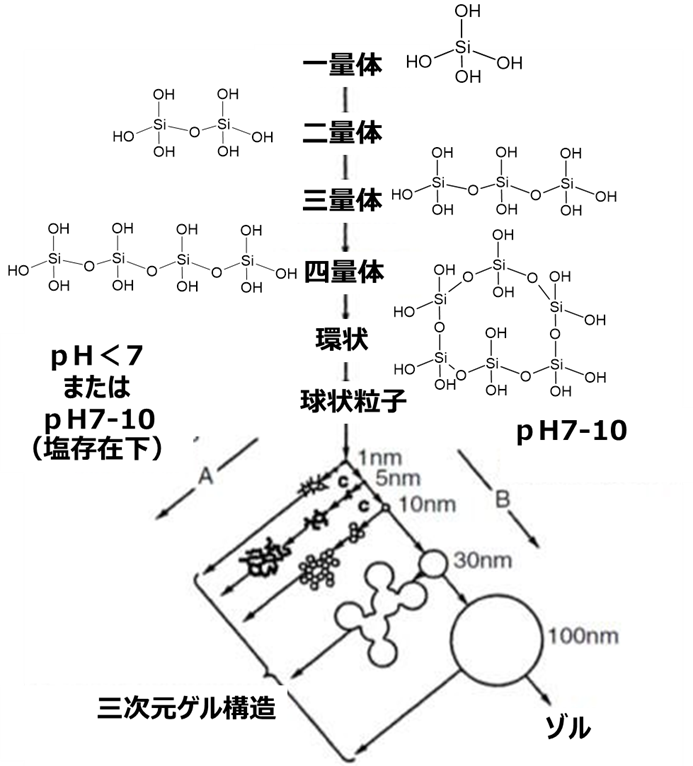
Fig13. シリカゾルと3次元ゲル構造との関係8)
電気二重層
上述しましたように一次粒子がそのまま成長するとコロイダルシリカになり、凝集するとその凝集の度合いにより、シリカゲル、沈降性シリカ、フュームドシリカに分類されます。シリカ一次粒子が単分散で存在するか凝集するかは、電気二重層が大きくかかわってきます。 一般に2つの異なる物質が接する界面には電位差が生じます。そのため、どちらかの物質中で荷電粒子が移動可能であれば、界面には必ず電気二重層が形成されます(Fig14)。
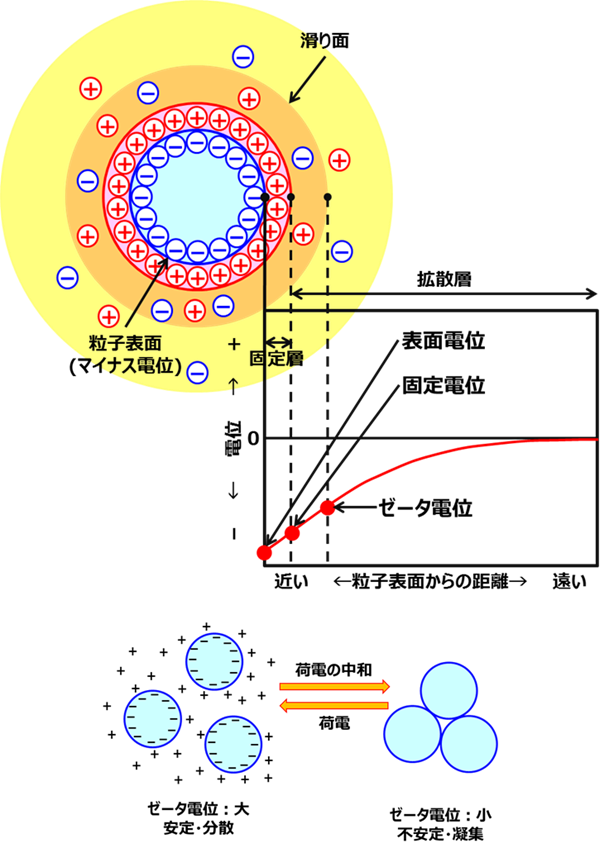
Fig14. 電気二重層とゼータ電位の関係9)
電気二重層とは、水電解質溶液中で固体表面が帯電すると,その電荷を打ち消すように正味の反対電荷が表面近傍の溶液中に分布することで形成され、コロイダルシリカ、のようなシリカ一次粒子の場合、一次粒子はマイナスに帯電しているため、それを打ち消す形で表面はプラスの電荷で覆われています。このプラスに帯電している相を固定層(Stern-Helmholtz層)といいます。この固定層より外側の静電引力の中で拡散しつつ濃度分布が生じる層を拡散層(Gouy-Chapman層)といい2つの層で構成されています。
ゼータ電位とは、溶液中の微粒子の周りに形成する電気二重層中の、液体流動が起こり始める「すべり面」の電位として定義されます。 これがゼロに近づくと、微粒子の相互の反発力は弱まりやがて凝集してしまいます。
つまり、ゼータ電位が大きいときはシリカ一次粒子どうしがが安定するため分散していますが、ゼータ電位が小さいと不安定になり、一次粒子どうしがくっつきあって凝集します。このため、シリカのゲル化には、電気二重層の原理を基本としてゼータ電位の制御がとても重要になります。
おもな非晶質シリカの製法と粒子構造
シリカゲル
シリカゲルは、20世紀初頭に潜水艦内部の乾燥を目的としてアメリカで量産化されました。工業的にはケイ酸ソーダに硫酸を加えて作られ、化学式で表すとFig9のようになり、中和反応により製造されます。
ケイ酸ソーダ中のシリカは硫酸との中和反応により一次粒子が形成され、この一次粒子同士がくっつき三次元構造が形成されることでシリカゲルが作られます。この一次粒子から三次元構造が形成される工程をゲル化と呼びます。この状態では、副生成物の硫酸イオン(SO42-)とナトリウムイオン(Na+)
が大量に含まれているため、これを水洗により除去します。この時点では、大量の水が含まれているためシリカヒドロゲルと呼ばれています。このシリカヒドロゲルを乾燥して、グレードによっては細孔径を調整後、粒度を揃えて製品となります。
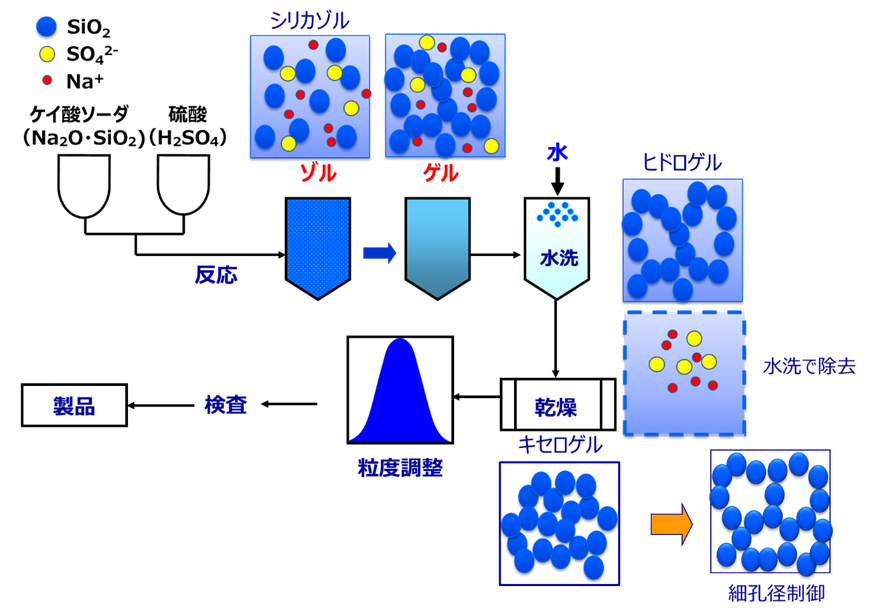
Fig15. シリカゲルの製法と粒子の構造の変化
シリカゲル粒子の構造
Fig16に示すようにシリカゲルは、直径 数nm~数十nmの一次粒子(骨格粒子)がたくさん集まって構成されていて二次粒子が製品となります。一次粒子の集合により、細孔が形成され、電子顕微鏡で観察すると、白色部がシリカ一次粒子の凝集、黒色部は細孔でその存在が確認できます。細孔径、細孔容積、比表面積は、一次粒子径とその結合度合いに影響されるため、これらを制御することにより、さまざまな種類のシリカゲルを製造することができます。このため、乾燥剤、衣食住、医薬品などさまざまな分野で使用されてます。

Fig16. シリカゲルの粒子構造のイメージと粒子表面の電子顕微鏡写真
このようにシリカゲルは、他の非晶質シリカに比べ、ゲル化による3次元構造が強固であることから、シリカゲルと呼ばれています。
沈降性シリカ
沈降性シリカは、沈降シリカともいわれています。沈降性シリカは、珪酸ソーダを攪拌しながら硫酸を滴下して中和して得られたシリカスラリー中の固形成分(沈降性シリカ)をフィルタープレスなどで、分離・回収、水洗で余分なケイ酸ソーダや硫酸を洗い流した後、乾燥して粒度調整後に製品となります(Fig17)。
沈降性シリカは、タイヤ等で炭素粉(カーボーンブラック)と同様に補強材として用いられるため、カーンブラックに対して、ホワイトカーボンとも呼ばれています。タイヤはじめ合成ゴムの補強充填剤、農薬の担体、新聞用紙の填料、合成樹脂の配合剤、塗料・接着剤・印刷インキ等の増粘剤、練り歯みがきの配合剤等々、幅広い用途に使用されています。

Fig17. 沈降性シリカの製造概略10)
沈降性シリカ粒子の構造
シリカゲルに比べて大きな一次粒子が凝集した構造をとるため、比表面積が低く、緩い凝集構造を形成しているため、非常にかさ高い特徴があります(Fig18)。
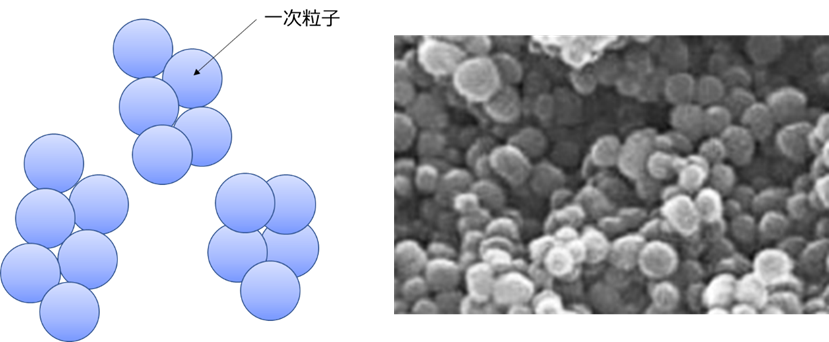
Fig18. 沈降性シリカの粒子構造のイメージと電子顕微鏡写真11)
フュームドシリカ
フュームドシリカ(Fumed Silica、微粒子シリカ)は、1942年にカーボンブラックの代替品としてドイツDegussa社(現・Evonik Industries社)の化学技術者H. Kloepferによって開発され、煙の
ような外観からフュームドシリカと呼ばれています。また合成法から乾式シリカや火炎加水分解法シリカとも呼ばれます。フュームドシリカは、液体の増粘・チキソトロピー性付与、粉体の流動性改善、エラストマーの補強などの機能を持ち、塗料、印刷インキ、接着剤、プリンタートナー、ゴムなど幅広い分野で利用されています。
フュームドシリカは、主に火炎加水分解法で製造されています。火炎加水分解法とは、シリカ原として四塩化ケイ素を用い、1000℃程度の高温バーナー中で反応させてフュームドシリカを得る方法です。
反応を化学式で表すと、四塩化ケイ素が加水分解されてシリカ単量体が生成します(Fig19)。この単量体がFig 11のようにオリゴマーを経て一次粒子が形成されフュームドシリカになります。火炎加水分解工程で得られたフュームドシリカには塩酸が大量に含まれているため、その後の脱酸工程で塩酸を除去して製品となります。また、粒度や比表面積等の物性は加水分解反応時の反応条件を変えることでコントロールできます。更に、バーナーの代わりにアーク放電やプラズマを用いる反応法もありますが、基本的な原理は変わりません。
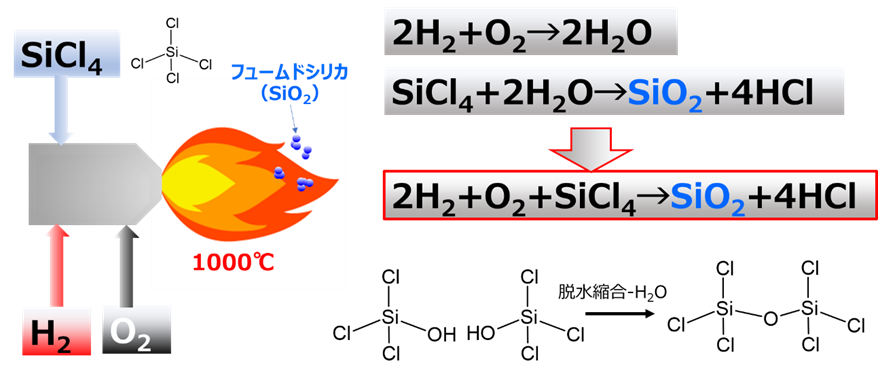
Fig19. フュームドシリカ製造のイメージと反応式12)
フュームドシリカ粒子の構造
フュームドシリカの一次粒子は数nmから数十nm非常に小さく、この一次粒子どうしが数珠状にくっついてナノサイズの二次粒子を形成しています。したがって、二次粒子の凝集力も大きく、電子顕微鏡で観察した場合、シリカゲルのような一次粒子の凝集体のように見えますが、実際は二次粒子が集まって更に凝集体を形成するというのが特徴になります(Fig20)。
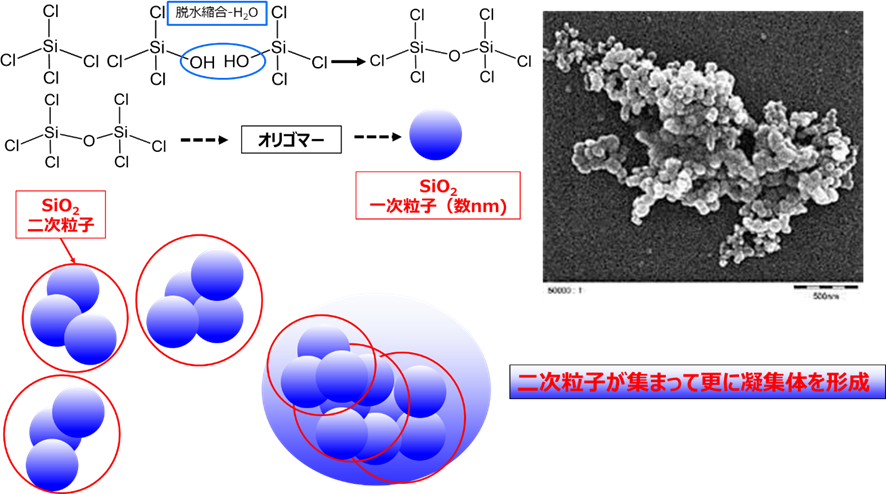
Fig20. フュームドシリカの粒子構造のイメージと電子顕微鏡写真13)
多孔質ガラス
多孔質ガラスは1940年頃に米国の特殊ガラスメーカーであるコーニング社により開発され、多孔質ガラスを高温で処理し、無孔化したものは96%の高ケイ酸質で「バイコールガラス」の商標で知られています。当初、多孔質ガラスは「バイコールガラス」の中間製品でしたが、均一な径の貫通細孔を持ち、最大で数百m2/gの比表面積を持つことから、多孔体としての応用研究されるようになったのがはじまりとなります。
多孔質ガラスの製法は、分相法、ゾル・ゲル法に大別され一般的には前者で作られていますが、金属などの不純物が極めて少ない高純度のものは後者の方法作られます。
分相法
多孔質ガラスは、Fig6のようにケイ酸ソーダの原料のカレットの製法と原理的には同じです。はじめに、SiO2(ケイ砂)、H3BO3(ホウ酸)、Na2CO3(ソーダ灰)を混合し、溶融によりNa2O-B2O3-SiO2系ガラスを作製します。これを成形した後、数百℃で熱処理を行うと、ガラス内部でSiO2リッチ相とNa2O-B2O3リッチ相に数nmのスケールでスピノーダル分解により分相が起こります。
通常溶液は濃度の高いところから低いところへと物質が移動して濃度の差をなくそうとしますが、ある条件のもとでは逆に濃度の高いところへ移動することがあり、濃度の高い部分と低い部分とが入り組んだ構造になります。こうした現象をスピノーダル分解といいます。
スピノーダル分解により、SiO2リッチ相とNa2O-B2O3リッチ相に分相されたガラスを酸溶液に浸漬すると、Na2O-B2O3相のみが酸で溶出され、SiO2骨格を持つ多孔質ガラスが得られます(Fig21)。
Na2O-B2O3相のみが酸で溶出され、SiO2骨格を持つ多孔質ガラスが得られます(Fig19)。
多孔質ガラスは細孔径分布がシャープなため、分離フィルターや触媒の担体などをはじめ、クロマトグラフィー用担体、エマルション調製用デバイスや有害物質の吸着等に用いられています。更に、最近では生体触媒や固定化酵素用の担体として用いられています。
多孔質ガラスは細孔径分布がシャープなため、分離フィルターや触媒の担体などをはじめ、クロマトグラフィー用担体、エマルション調製用デバイスや有害物質の吸着等に用いられています。更に、最近では生体触媒や固定化酵素用の担体として用いられています。
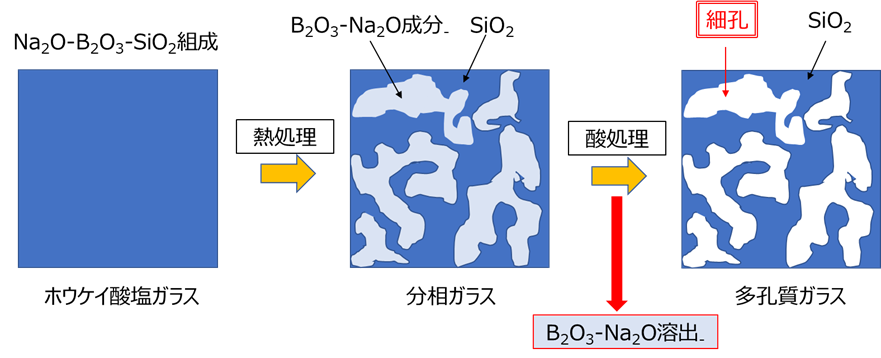
Fig21. 多孔質ガラスの製法と分相のイメージ14), 15)
ゾル・ゲル法
多孔質ガラスのゾル・ゲル法とは、テトラエトキシシラン(TEOS)のようなアルコキシドシランの加水分解反応により、ケイ酸モノマーを生成させる方法です。
この反応では、TEOSが加水分解によりケイ酸モノマーが生成するとともに、複生成物にエタノールが生成します。このケイ酸モノマーが、脱水縮合により一次粒子が形成されます(Fig22)。
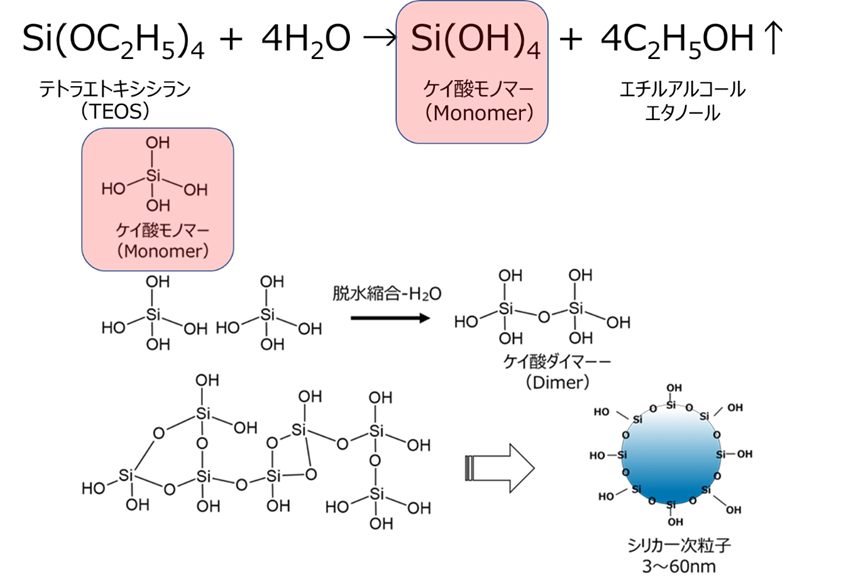
Fig22. テトラエトキシシラン(TEOS)を用いたシリカモノマー合成反応と一次粒子形成のイメージ16)
この反応は、シリカ原は異なるものの、基本的にはシリカゲルの製法と同じです。実際、実験室レベルでは、上記の方法でシリカゲルを作ることがあります。
ゾル・ゲル法による多孔質ガラスの製造プロセスと細孔にイメージをFig20に示します。まず、水にエタノールとテトラエトキシシランを混合、攪拌します。このときにシリカ一次粒子が形成されゲル化が進行します。ゲル化後、乾燥をさせて、エタノールを除去して、1200℃程度で焼成を行うことで多孔質ガラスが作られます。細孔の形成は、まずは、生成した一次粒子が互いにくっつきあってゲル化をする際に、これら一次粒子どうしの隙間が細孔となります。次の乾燥工程では、脱エタノールにより全体が収縮するため、細孔容積を大きく取るためには、できるだけ収縮を抑える工夫が必要です。乾燥後、焼成を行うことで、分相法と同様にスピノーダル分解により細孔が形成されます。このとき、あらかじめ高分子の有機材料を混合しておくことでμmオーダーの細孔を持つ多孔質ゲルが得られることが報告されています。14)
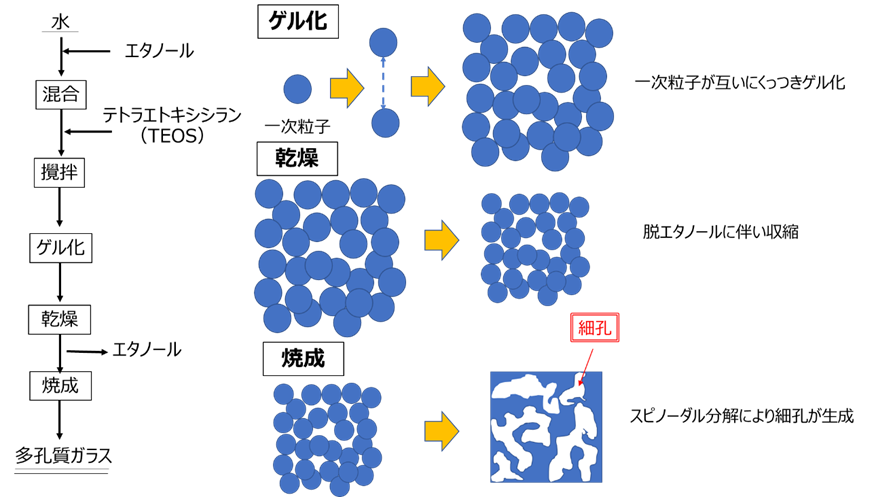
Fig22. ゾル・ゲル法における多孔質ガラスの製造プロセスと細孔の形成イメージ17)
多孔質ガラスの構造
分相法、ゾル・ゲル法ともに、多孔質ガラスの構造は、基本的にはマイクロメートルオーダーの網目状の骨格が繋がった構造を有しています。この特徴的な多孔体構造をモノリスといい、電子顕微鏡で観察すると、ジャングルジムのような骨格が連なった構造をしています。
また、ゾル・ゲル法によっては、モノリス構造に一次粒子間の空隙を持たせたバイモーダル構造のものも上市されています18)。

Photo4. 分相法による多孔質ガラス表面の電子顕微鏡写真19)
まとめ
非晶質シリカには、珪藻土のように天然のものと、珪砂等の天然の結晶性シリカを原料とするものに大別されます。後者は、結晶性シリカの構造を熱エネルギーなどで一旦バラバラにして、再度組みなおすことで非晶質化しています。このタイプの非晶質シリカには、シリカゲル、沈降性シリカ、フュームドシリカがあり、一次粒子をもとに構成される二次粒子の構造により、物性が決まります。これら二次粒子の構造には、電気二重層とゼータ電位が大きく関係します。
また、多孔質ガラスにおいて、細孔構造の形成法は、製法により分相法、ゾル・ゲル法に分類されますが、双方とも細孔の形成はスピノーダル分解によるものです。
このように、結晶性シリカと非晶質シリカには関連性があり、非晶質シリカどうし共通する工程が多く、これらの組み合わせにより、多くの種類の非晶質シリカが作られています。
先にも述べたように、結晶性シリカの構造をばらばらにするには1000℃以上の高温を要し、大量の熱エネルギーを消費しています。このため、この工程をより低温でできればエネルギー消費を抑えることができ、CO2発生も抑えられると考えられます。
参考文献
1) 大久保硝子店 https://www.okubo-glass.co.jp/knowledge/
2) Wikiwand https://www.wikiwand.com/ja/%E3%82%AC%E3%83%A9%E3%82%
3) Lab Brands https://lab-brains.as-1.co.jp/article/scienceknowledge/2021/07/474/
4) Wikiwand https://qr.paps.jp/LCu38
5) 光合成辞典 https://photosyn.jp/pwiki/index.php?%E7%8F%AA%E8%97%BB
6) クラフトワークHP http://cr-w.com/keisoudo
7) WR. Grace LUDOX® Colloidal Silica catalog
8) R.K.ILER, The Chemistry of Silica ,p174 をもとに筆者加筆
9) イビデンエンジニアリング株式会社 https://www.ibieng.co.jp/analysis-solution/g0035/
10) 特許第3998793号, 沈降性シリカおよびその製造方法, pp.6-8
11) FUJI SILYSIA CHEMICAL LTD. https://www.fujisilysia.com/technology/
12) ナノマテリアル情報提供シート, 日本アエロジル株式会社, 経済産業省, p11を参考に作成
13) 藤野 秀幸 J. Jpn. Soc. Colour Mater., 88〔8〕,279–281(2015)
14) 大澤ら, 多孔性ガラスの製法とその特性およびSize Separationの応用, 綜説(Review Article): 膜(MEMBRANE),4(4),221-227(1979)
15) 矢澤 哲夫 総論:多孔質ガラスの高機能化と実用化NEW GLASS Vol.1 (2008) P4
16) 多孔質ガラス http://m-uo.com/research/porous.html
17) 中西 和樹 ゾル-ゲル法の基礎と応用―ゲル網目の形成と相分離を中心として 第30回セミナ-講演録 ゾル-ゲル法の現状と将来展望 NEW GLASS vol.8, No.3 pp. 186-187
18) 株式会社エスエヌジー https://www.sng-inc.co.jp/t-monolith/
19) 株式会社環境レジリエンス http://kankyo-resilience.co.jp/research/pg.html


-300x188.png)

-300x188.png)
-300x188.png)


コメント