はじめに
シリカは、衣食住をはじめさまざまな産業で使用されていますが、直接お目にかかることはあまりありません。しかし、私たちの生活には不可欠な素材です。シリカは安全性が高く、医薬品、化粧品、歯磨き剤、食品とわれわれの体に直接触れるところにも直接使用されていて、このようなところに使用されるシリカは法律により厳しい規制があります。
今回は、体に直接触れるシリカのなかで医薬品向けシリカに対する法的規制について解説をしていきます。
医薬品添加物とその規格
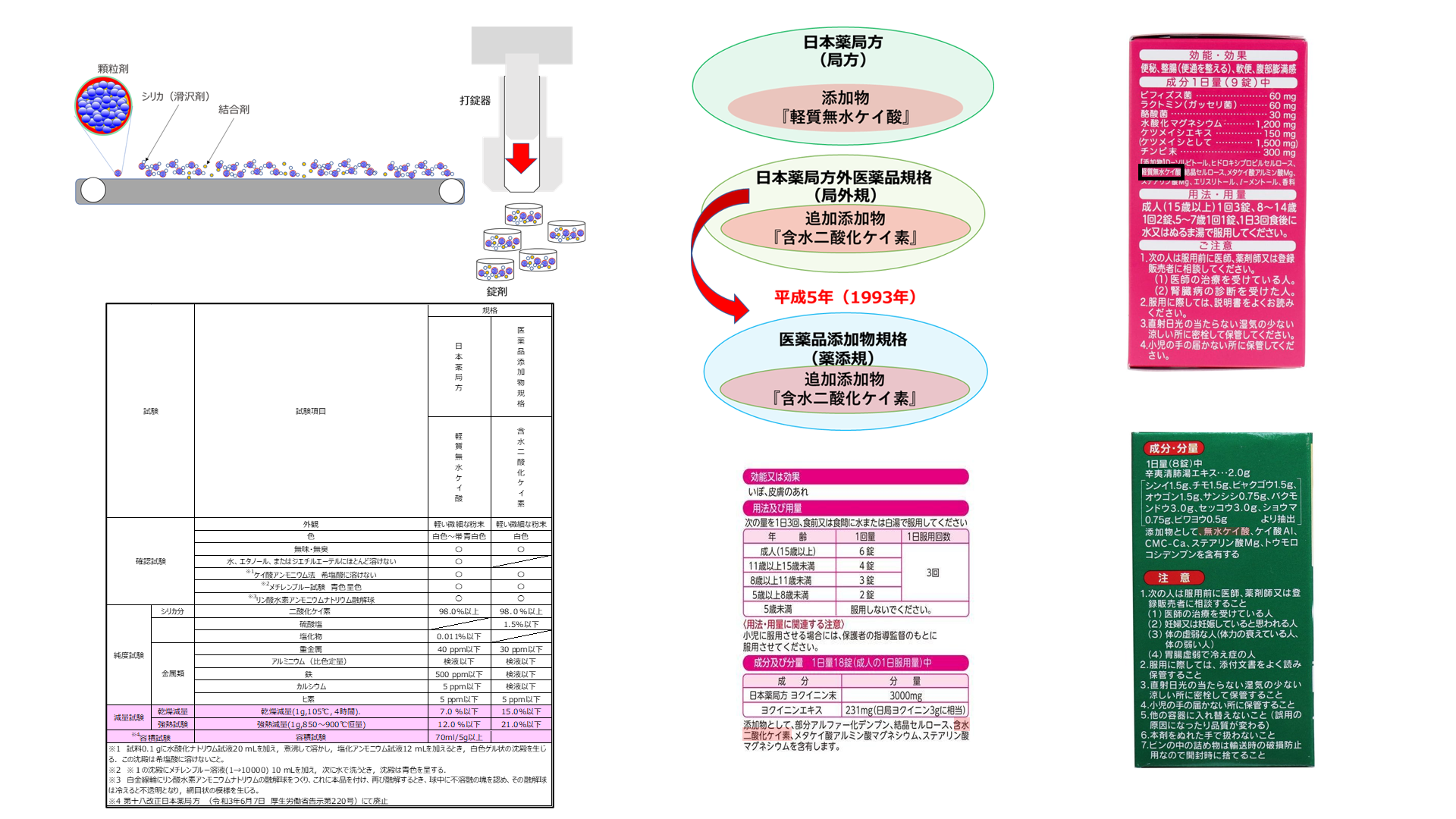
シリカは、主に医薬品の造粒、錠剤の機能を向上させる添加物として用いられ、医薬品に用いられる添加物は、日本薬局方、医薬品添加物のいずれかに収載されているものではいけません。
日本薬局方
日本薬局方(局方)とは、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第41条により、医薬品の性状及び品質の適正を図るため、厚生労働大臣が薬事・食品衛生審議会の意見を聴いて定めた医薬品の規格基準書です。添加剤は、使用目的を有効成分及び製剤の有用性を高める、製剤化を容易にする、品質の安定化を図る、使用性を向上させる、などとしています。加えて、その製剤の投与量において薬理作用を示さず、無害でなければならないことや有効成分の治療効果を妨げてはならないことが記されていて、日本薬局方でシリカは『軽質無水ケイ酸』の規格に該当したものが使用できます。
日本薬局方 医薬品各条ア~ソ https://www.mhlw.go.jp/content/11120000/000788360.pdf
医薬品添加物規格
医薬品添加物規格(薬添規)とは日本薬局方に収載されていない医薬品添加物の規格です。従来,「日本薬局方外医薬品成分規格」に収載されてきましたが、平成 5 年にこれを「日本薬局方外医薬品規格」及び「医薬品添加物規格」に分けられ、医薬品添加物の規格は「医薬品添加物規格」に収載されていて、『含水二酸化ケイ素』の規格に該当したものが使用できます。
医薬品添加物規格 2018 – 厚生労働省 https://www.mhlw.go.jp/content/11120000/000336088.pdf
日本薬局方、日本薬局方外医薬品規格、医薬品添加物規格の関係
日本薬局方外医薬品規格
1983年まで医薬品原料の規格は、日本薬局方に収載されている成分と、昭和 42 年の基本方針(厚生省薬務局長通知「医薬品の製造承認等に関する基本方針について」、昭和 42 年 9 月 13 日付、薬発第 645 号)以降に承認された新薬成分についてのみ、統一的なものが公表されていました。更に、それ以外の数百にも及ぶ成分については、後発品等の承認申請する企業が合理的と思われる規格を作成して承認申請し、厚生省が個別に審査して承認していました。
しかし、このようなやり方は,日本薬局方収載品のように、局方収載品として規格を簡略記載することができないため、申請企業の負担が大きいだけでなく審査業務が非常に繁雑となってしまいます。特に、後発医薬品等の審査は、先発品や使用前例のある添加物等の規格との照合作業や、規格が異なる場合には修正を求める返送作業等のために、審査担当者は多くの時間が割かれているのが当時の状態でした。更に、いったん承認を取得してしまうと、簡略記載した局方収載品のように、日本薬局方の規格が見直されれば自動的に最新の規格に読み替えられることもありません。そのため、その原料の規格は固定化され、科学技術の進歩に取り残されることになってしまいます。また、もし規格を最新のものに変更しようとしても一部変更承認申請の手続きが必要になります。このため審査課だけではなく、企業側からも統一した規格の作成が求められていました。
リンク『日本薬局方収載までの流れ』https://www.pmda.go.jp/files/000218887.pdf
そこで、上述した煩雑さを無くし、後発医薬品増加への対応、薬事研究の加速のため、国立衛生試験所(現国立医薬品食品衛生研究所)が中心となって作成した医薬品原料や医薬品添加物等の医薬品の成分規格をまとめたものが1982 年に日本薬局方外医薬品規格(局外規)として公表されました。局外規は第二薬局方に近い性格を持つものであり、日本薬局方に将来収載される可能性のある成分等が数多く収載されていました。また、局外規は,単に日本薬局方を補うという消極的な性格よりは、日本薬局方ではまねのできない、時代に迅速に対応できる規格集という積極的な性格を強く持っていました。1)
医薬品添加物規格
医薬品添加物規格(薬添規)は日本薬局方に収載されていない医薬品添加物の規格です。従来,「日本薬局方外医薬品成分規格」に収載されてきましたが、平成5年にこれを「日本薬局方外医薬品規格」及び「医薬品添加物規格」に分けられ、医薬品添加物の規格は「医薬品添加物規格」に収載されていて『含水二酸化ケイ素』の規格に該当したものが使用できます。
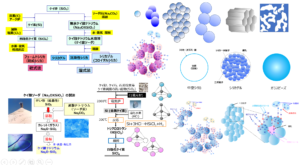
Fig1に医薬品用シリカ規格書収載の経緯を示します。
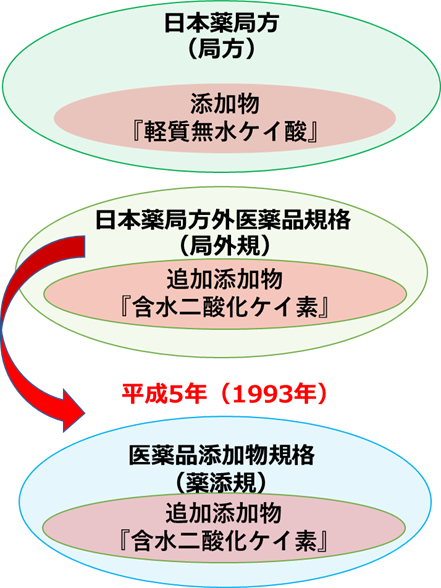
Fig1. 医薬品用シリカ規格書収載の経緯
医薬品に用いられるシリカ
日本薬局方、医薬品添加物規格は、人体に対して安全か、添加により薬に影響が無いものとする基準で定められており、これら規格をクリアした合成シリカが用いられていますが、比表面積、細孔容積、細孔径等の物理的性質については定められていません。更に、粒子径は、粉体であることのみが前提とされているだけです。このため、医薬品には、軽質無水ケイ酸、含水二酸化ケイ素と称したさまざまなタイプの合成シリカが用いられています。
軽質無水ケイ酸
二酸化ケイ素(SiO2)を98.0%以上含むもので、性状は、白色~帯青白色の軽い微細な粉末で、におい及び味はなく、滑らかな触感があるとされていて、水、エタノール又はジエチルエーテルにほとんど溶けないとされています。
用途: 流動化剤をはじめ、安定化剤 、滑沢剤、基剤、吸着剤、結合剤、懸濁(化)剤、光沢化剤、コーティング剤、湿潤剤、湿潤調整剤、着色剤、粘着増強剤、粘稠剤、賦形剤、分散剤、崩壊剤、崩壊補助剤、防湿剤、帯電防止剤などがあります。
最大使用量: 経口投与 2.6 gとなっています。
軽質無水ケイ酸を使用している医薬品: アカルボース錠、アリピプラゾール錠、アジスロマイシン細粒、アムロジピンOD錠、イマチニブ錠、エバスチン錠、オロパタジン錠、クラリスロマイシン錠、ボグリボースOD錠などなど多数の医薬品に用いられています。2)
含水二酸化ケイ素
二酸化ケイ素(SiO2)を95.0%以上含むもので、性状は、白色の軽い微細な粉末で、におい及び味はなく、滑らかな触感があり、水又はエタノールにほとんど溶けないとされています。
用途: 流動化剤をはじめ安定化剤、滑沢剤、基剤、吸着剤、結合剤、コーティング剤、充填剤、賦形剤、帯電防止剤などがあります。
最大使用量: 経口投与3.8 gとなっています。
含水二酸化ケイ素を使用している医薬品: アシクロビル顆粒、アトルバスタチン錠、イトラコナゾール錠、オランザピン細粒、セフニジピンカプセルなど多くの製品に使用されています。2)
Table1.医薬品添加物シリカの規格

軽質無水ケイ酸と含水二酸化ケイ素の違い
Table1に医薬品向けシリカの規格一覧を示します。『軽質無水ケイ酸』と大きく異なる点は、含水率と容積です。含水率は、乾燥減量と強熱減量で乾燥減量は、1gの試料を105℃4時間加熱した減量を重量パーセントで表したもので、強熱減量は1gの試料を850℃から900℃で重量変化がなくなる(恒量)まで加熱してその減量を重量パーセントで表したもので、一般に含水率というのは乾燥減量を表します。また、容積試験とは、5gの試料が占める容積で、200mℓのメスシリンダーに5gの試料を静かに投入してそのときの容積を計測します。
軽質無水ケイ酸は、乾燥減量7.0%以上のものは使用できないため、シリカ粉体の取り扱いに大きく影響します。シリカ粉体は、適度な含水により、帯電や飛散を防止させるという効果がありますがそれが難しく、更に、吸湿性の高いシリカでは高温、高湿な環境では規格上限を上回ってしまう場合があり、含水により容積試験値も下回ることとなります。このため、含水二酸化ケイ素では、文字通り含水率を上げるために乾燥減量が15.0%まで引き上げることができます。更に、容積試験値もありません。
また、令和3年の第十八改正日本薬局方では、軽質無水ケイ酸から容積試験が廃止となり、ますます含水二酸化ケイ素との境界が無くなってきています。
表示例
一般医薬品の外箱に添加物は有効成分と区分して名称を記載しなければいけません。軽質無水ケイ酸は、軽質無水ケイ酸若しくは無水ケイ酸、含水二酸化ケイ素は含水二酸化ケイ素とそのまま表示します。以下に表示例を示します。

軽質無水ケイ酸の表示例

無水ケイ酸の表示例

含水二酸化ケイ素の表示例
その他の規格
海外規格との関係
Table2に医薬品向けシリカに関係する国内規格と海外規格を示します。
Table2. 医薬品向けシリカに関係する国内規格と海外規格

米国ではUSP/NF(米国薬局方-国民医薬品集)、EUではEP(欧州薬局方)では、中国では中国薬局方のように、各国でシリカは医薬品添加物として認可されています。
ちなみにUSP/NFは2種類の公的基準が合わさってひとつになった出版物ですが、米国薬局方(USP)には医薬品の有効成分と製剤の規格(医薬品各条)が掲載されている他、別のセクションに栄養補助食品の規格(各条)が掲載されています。
USP/NF http://ftp.uspbpep.com/v29240/usp29nf24s0_m75270.html
European Pharmacopoeia(EP) http://www.uspbpep.com/ep60/silica%20colloidal%20hydrated%200738e.pdf
3局対応
日米欧三薬局方検討会議(PDG:Pharmacopoeial Discussion Group)は、欧州薬局方(EP)、日本薬局方(JP)並びに米国薬局方(USP)の試験法と医薬品各条について、調和活動を行う、三薬局方に関する会議で、最近では3局の規格に対応できるシリカも上市されています。
FDA におけるドラッ グマスターファイル(DMF)制度
DMF 制度は,医薬品原料,医薬品添加物,包装材料など についての品質などに関する情報を,あらかじめそれぞれ の原料や材料メーカーなどが FDA に登録しておくことによって,それを使用して最終製品を製造する製薬メーカー は,個別の情報をそれぞれのメーカーから入手することなくFDA への最終製品の申請が出来るというもので、最近は中国でも導入されています。
医薬品添加剤GMP自主基準
GMPとは
医薬品は、病気の治療や予防などの保健衛生に用いられ、人々の健康や生命に直接関与しています。そのため、医薬品を製造する際は、定められた品質規格に適合することを確認するだけでなく、製造する過程についても適切に管理し、品質の良い優れた医薬品を恒常的に製造する必要があります。
このような医薬品を製造するための要件をまとめたものがGMP(Good Manufacturing Practice)であり、日本語では「医薬品の製造管理及び品質管理の基準」と表現されています。
GMPの三原則
GMPを理解するうえで重要な考え方として「GMPの三原則」があります。
1. 人為的な誤りを最小限にすること
2. 医薬品の汚染及び品質低下を防止すること
3. 高い品質を保証するシステムを設計すること
医薬品添加剤GMP自主基準
日本薬局方収載医薬品のうち専ら医薬品添加物(剤)として用いられるものについては、人体に対する作用が緩和なものとしてGMP省令の適用外です。このため、日本医薬品添加剤協会が、日本薬局方収載品を含む医薬品添加剤の品質確保を図るため医薬品添加剤の製造業者に対し「医薬品添加剤GMP自主基準」を策定しました。
医薬品添加剤GMP自主基準は、医薬品添加剤の品質を保証するために必要な品質マネジメントのプロセスを明確にする必要があり、一般的要求事項と文書化に対する要求事項があります。これら要求事項は、医薬品添加剤の品質を保証するために必要な品質マネジメントのプロセスを明確にすること。更に、外部に委託される場合でも、製造業者は委託した業務について医薬品添加剤の品質保証に関連する管理項目を明確に業務委託先に示すことが要求されています。
医薬品添加剤GMP自主基準 http://www.jpec.gr.jp/document/gmp2016.pdf
ちなみに医薬品添加剤の製造業者には、購入したものを小分け包装して医薬品添加剤として販売するような、いわゆる「リパック業者」や試験検査のみを行い医薬品添加剤として販売する業者も含まれます。
医薬品添加剤の製造業者に対して、医薬品メーカーが外部監査を実施するような場合に、本基準を参照されることが望まれるため、多くの医薬品添加物メーカーが医薬品添加物GMP自主基準(GMP自主基準)を取得しています。医薬品添加剤は複数のメーカーが使用する場合が多く、その監査は双方にとって負担が大きいため、本基準を有している医薬品添加物メーカーは、医薬品添加物協会が実施する監査に合格しているため、医薬品メーカー各社が行う監査の代用となる場合があります。
まとめ
医薬品には、軽質無水ケイ酸、含水二酸化ケイ素と称したさまざまなタイプの合成シリカが用いられていますが、段々軽質無水ケイ酸、含水二酸化ケイ素の境界がなくなってきていて、今後統合されていくものと筆者は考えます。また、近年は、後発医薬品(ジェネリック医薬品)の競争に伴い、顆粒やカプセルから錠剤へ剤形変更、更には錠剤を小型化、叙放性を付与するような製品が上市されています。このため、今後、合成シリカの用途はますます広がっていくものと期待され、新しいタイプの医薬品向け合成シリカが出てくる可能性があると考えています。
また、近年では、分析機器の高度化による、厳格な分析が求められてきています。例えば、元素不純物の分析については、原子吸光光度法に代わり、より分析精度の高いICP発光分析法や、更に分析精度が高い質量分析法により測定、管理する方法が記されています。
参考文献
1) 土井 脩 局外規作成の目的 Pharmaceutical and Medical Device Regulatory Science Vol. 44 No. 12(2013)p. 1016
2) アイアール技術者教育研究所 【医薬品製剤入門】流動化剤の基礎知識[医薬品添加物の解説⑦]https://engineer-education.com/fluidizer_pharmaceutical-additive/


-300x188.png)

-300x188.png)
-300x188.png)
コメント