アルコキシシランとは?
アルコキシシラン(alkoxysilane)は、ケイ素(Si)にOR基(alkoxy group)が結合した化合物の総称です。また、OR基は別名アルコキシドと呼ばれ、アルコール化合物という意味です。アルコキシドは他の有機金属に比べて発火しにくい、揮発性の物質が多い、複合金属酸化物を作りやすいなどの特徴を有しています。
基本構造
Fig1にアルコキシシランの基本構造を示します。
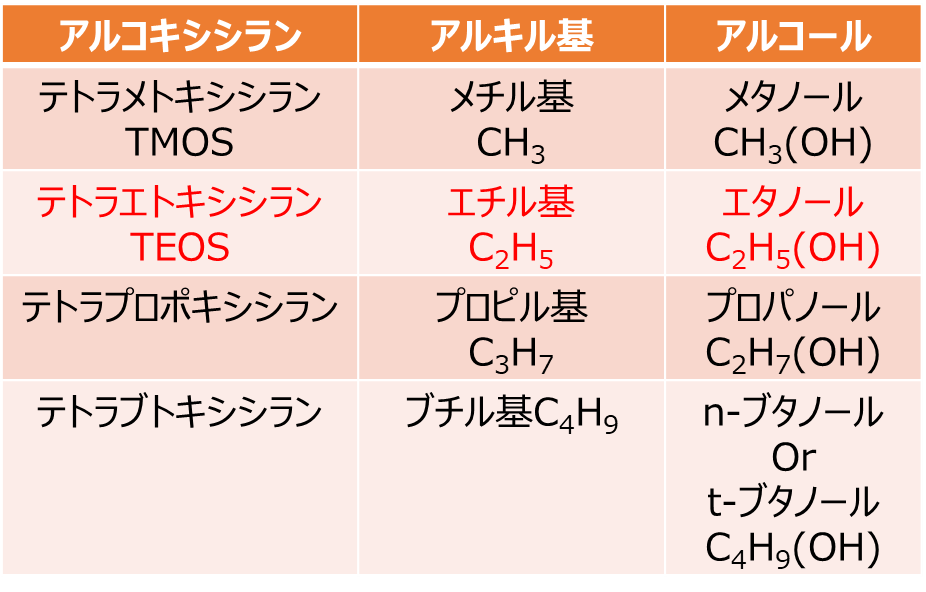
Rはアルキル基といい、アルコキシシランの1種であるテトラメトキシシラン(TMOS)は、アルキル基がメチル基(CH3)、テトラエトキシシラン(TEOS)は、エチル基(C2H5)、テトラプロポキシシランはプロピル基(C3H7)、テトラブトキシシランはブチル基(C4H9)となります。
このうちブチル基は、2種類の構造異性体が存在するため、直鎖のものを(n-ブチル基)、側鎖のものを(tert(t)-ブチル基)とそれぞれnとtの接頭辞を付けて区分します。ちなみにtertはターシャリー(tertiary)の略です。
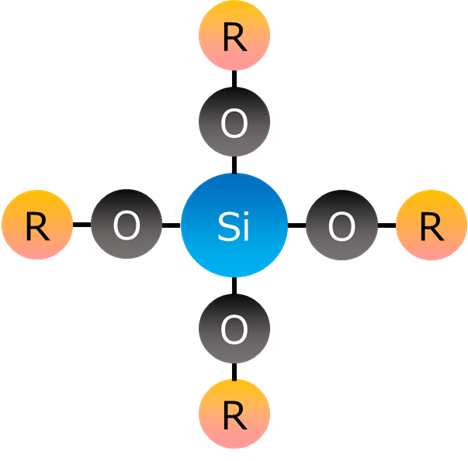
Fig1. アルコキシシランの基本構造
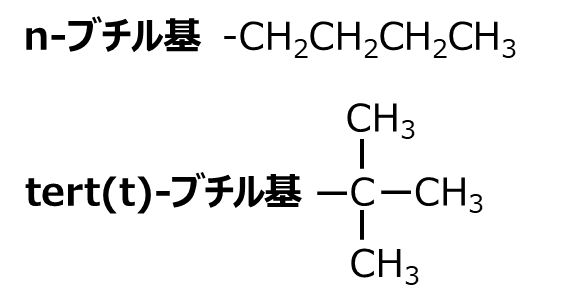
Fig2. n-ブチル基とtert (t)ブチル基
工業的にアルコキシシランは、触媒下で四塩化ケイ素(SiCl4)にアルコール(ROH)を反応させて作られ、反応式は以下の通りです。

このアルコールがメタノールの場合にはTMOS、エタノールの場合はTEOSと原料アルコールによりORが制御できます。更にブチルアルコール(ブチルアルコール)の場合、直鎖(n-ブタノール)、側鎖(t-ブタノール)となり構造も制御できます。
例えば、TEOSの場合は、原料アルコールとしてエタノールが用いられ、四塩化ケイ素と反応させることで、テトラエトキシシラン(TEOS)が得られます。しかし、すべての反応で塩酸が生成し、塩酸は腐食性が高く、金属を容易に腐食するため実際は耐酸設備で行われています。

Table1. 主なアルコキシシランとアルキル基およびベースとなるアルコール
テトラエトキシシラン(TEOS)
テトラエトキシシランTEOSは、別名、オルトケイ酸テトラエチル、正ケイ酸四エチル、ケイ酸エチルとも呼ばれます。
さきほど示しました反応は、基本は1846年にエーベルメンによって確立された反応で、日本が江戸時代の時には既に確立された反応です。このため、TEOSは古くから知られたアルコキシドとなります。
アルコキシシランは、シランカップリング剤としての性質も持っています。
シランカップリング剤とは、分子内に有機材料および無機材料と結合する官能基を併せ持ち、有機材料と無機材料を結ぶ働きをすることから、複合材料の機械的強度の向上、接着性の改良、樹脂改質、表面改質などに使用できます1)。
性状
TEOSは、沸点が約169℃、蒸発熱 約220J/gで室温では蒸発しにくい液体です。無色透明な液体です。水には基本的不溶で、徐々に加水分解していきます2)。
しかし、塩酸などの酸を加えると直ちに加水分解して白く濁り、エタノールと二酸化珪素SiO2になります。

Photo1.TEOSの外観3)

水には溶けにくいですが、有機溶剤一般にはよく溶けます。このため、一般の樹脂類に対しても親和性を示し、膨潤させたり溶出させたりするので、接液材料に樹脂類を用いることは避けるか、事前評価が必要となります。2)
危険性
ヒトに対する毒性
吸入毒性
TEOSは呼吸により体内に吸収されるおそれがあります。吸入の毒性評価として、吸入致死濃度LC50(ラット)があり、2500ppmとなり、1時間当たりのLC50(ラット)2000ppm以下のものは劇物となるため、劇物よりは致死量は低いですが注意が必要です。このため、作業場許容濃度TLV-TWA 10ppm(ACGIH 1995-96)と定められていて、85ppmでアルコール様の特異臭が感しられ、1,000ppm程度より刺激が強くなるといわれています。
血液系の毒性
脂溶性であり水に溶けにくいため血液系への特徴的な毒性が指摘されています。
体内での反応
酸があると反応して、加水分解してシリカとエタノールを生成します。
先にも述べましたように、TEOSは、沸点が約169℃、蒸発熱 約220J/gで室温では蒸発しにくい液体のため、加熱したほうがより危険性が高くなるため注意が必要です。
火災危険性
TEOSの火災に関する物性値等は下記の通りです。
引火点 56.3℃
発火点 248℃
燃焼範囲 0.7~5.75%
燃焼熱 5,526kJ/mol
炎色 なし
煙色 白色
皿に入れたTEOSをライターで火を点けることはできませんが、紙に染み込ませれば燃えます。大量でなければ、フタをかぶせるなどの窒息をさせればすぐに消え、再着火することはほとんどありません。
水に浮き、加水分解で可燃性のエタノールを発生するので、水消火は好ましくありません。火炎の熱で蒸気圧が上昇して、容器内圧力が高くなるため、容器破損から漏洩することを防止する必要があります。漏れた時は、少量ならば紙、砂、バーミキュライトなどの吸収剤で除去し、少量ずつ水に沈めて置くのが良いでしょう。
燃焼範囲の下限0.7%は、引火点の45℃に近い47℃の蒸気圧に相当するので、 『容器は高温にならない所に保管してください』と注意喚起されてます。
また、TEOSは電気抵抗率が大きく静電気を帯びやすいので、容器や配管の十分な接地や、接続前の放電が必要です。特に高周波装置の近くでは、漏洩電流や配管がアンテナとして作用する誘導電流によって微少火花が発生し得るので、注意してください4)。
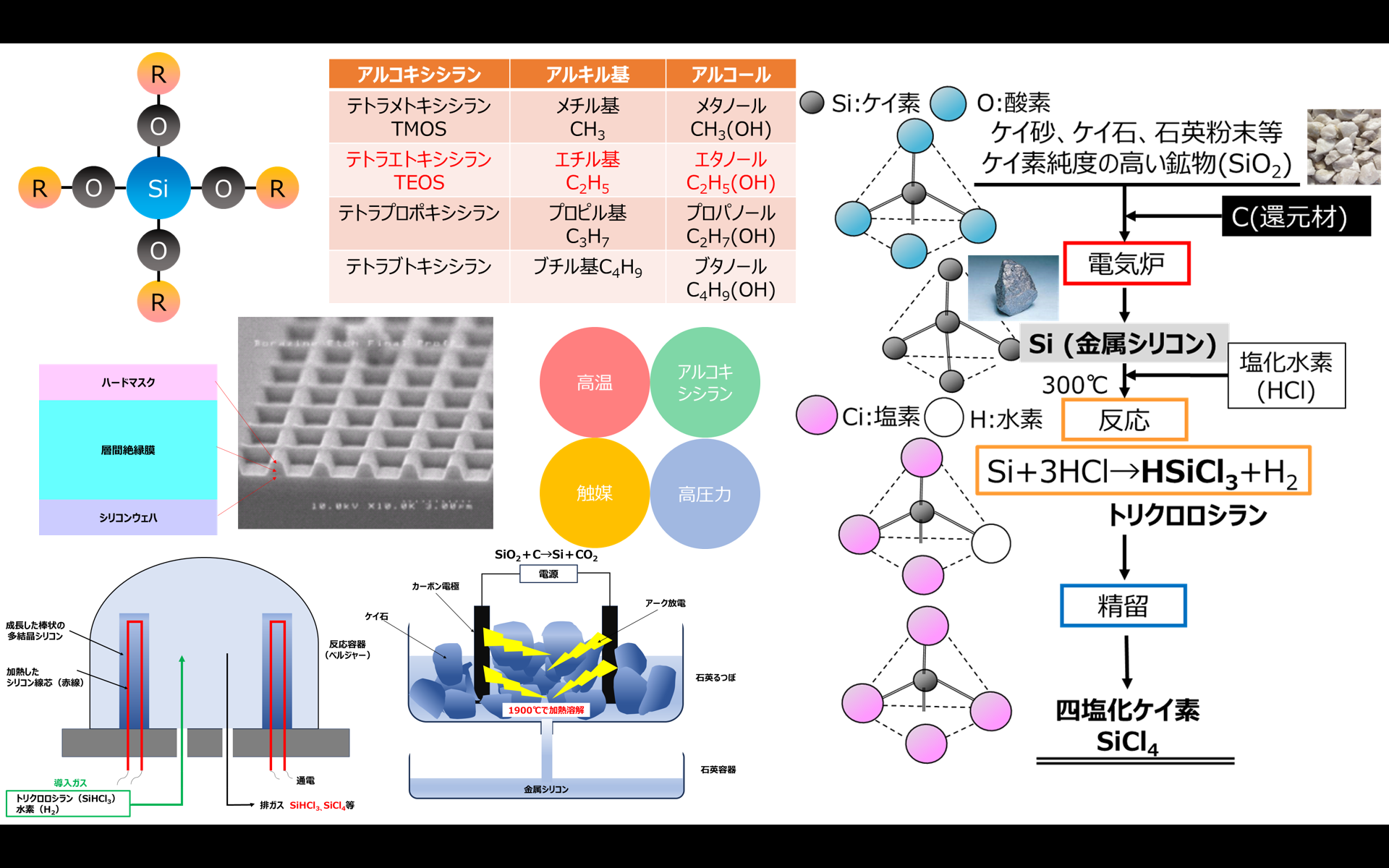
四塩化ケイ素の製造方法
先ほど述べたようにTEOSは四塩化ケイ素とアルコールを触媒下で反応して製造されます。
Fig2に示すように、四塩化ケイ素は、ケイ石をはじめシリカ純度が高い鉱物に炭素を加えて、高温で還元焼成して金属ケイ素(金属シリコン)にした後、塩化水素で反応させてトリクロロシランを作り、これを精製することにより四塩化ケイ素が得られます。
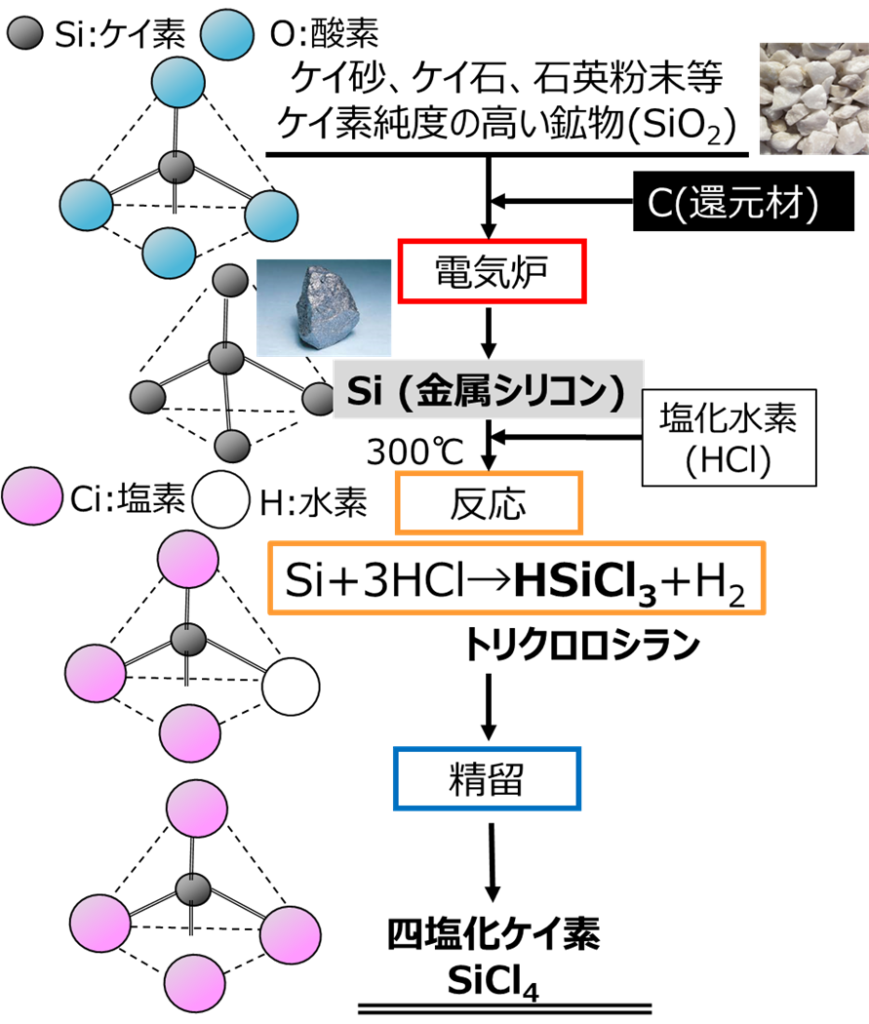
Fig2.四塩化ケイ素の工業的製法
一般に、還元焼成はアーク法により行われます。ケイ石が入った石英るつぼの中に、炭素で電極をセットして電流を流すとアーク放電により、1900℃に加熱されてケイ石は加熱溶解されます。このとき炭素電極により還元も同時に行われるため金属シリコン(Si)となり、副産物として二酸化炭素が生成して、以下のような反応式で表すことができます。
SiO2+C→Si+CO2
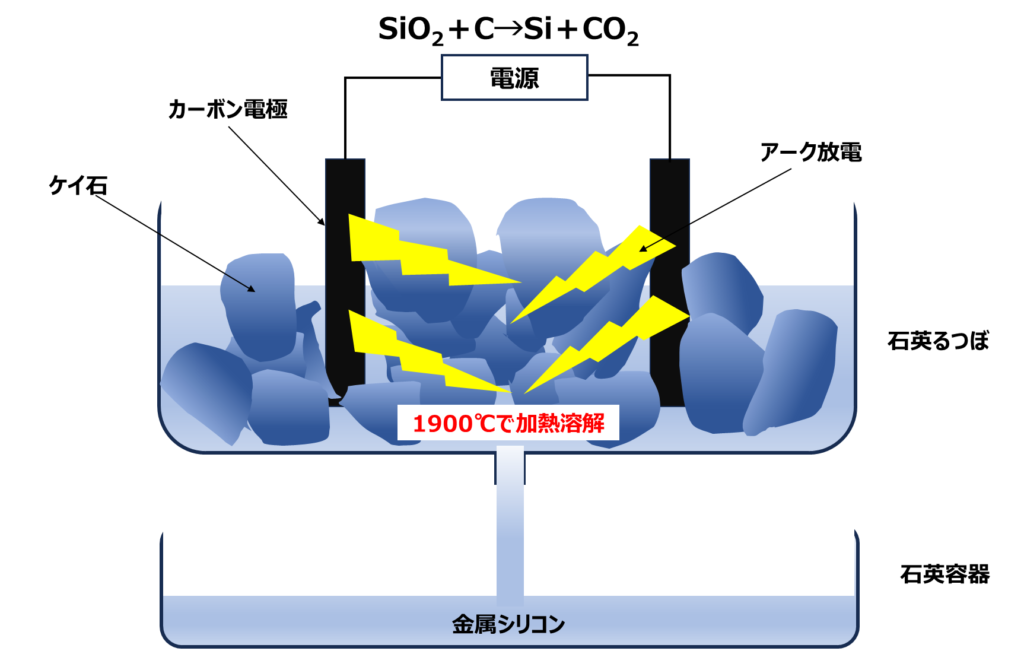
Fig3.アーク法による金属シリコンの製法5)
生成した金属シリコンは溶融して液体状態のため、別の石英容器で受けます。
更に、トリクロロシランは、シリコンウェーハの原料として用いられ、主にCVD法で製造されます。
CVD法とは、化学気相成長(Chemical Vapor Deposition)の略で、目的となる薄膜の原料ガス(気体)を供給し、熱、プラズマ、光などのエネルギーを与えて化学反応により膜を堆積する方法です。す。
反応容器(ベルジャー)にシリコン線芯をセットして通電により加熱して、トリクロロシランと水素の混合ガスを導入します。トリクロロシランは次の反応式によりシリコンになり、シリコン線芯の上で棒状の多結晶シリコン(Si)に成長して、排ガスとして四塩化ケイ素や余剰なトリクロロシランが生成します(Fig4)。
4HSiCl3→Si+3SiCl4+2H2
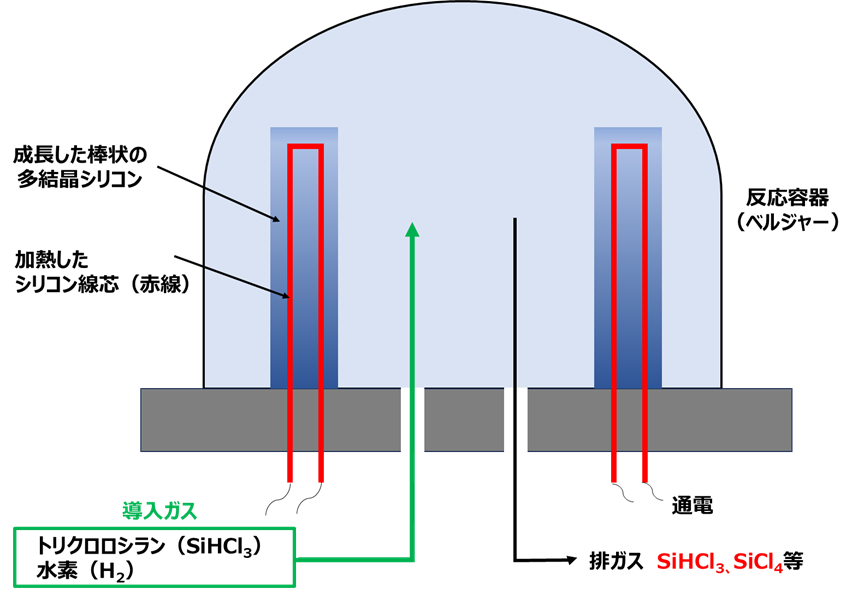
Fig4. CVD法による多結晶シリコン製造6)
この排ガスを精留することにより四塩化ケイ素が得られます。つまり、四塩化ケイ素はシリコンウェーハ製造による副産物として得られ、シリコンウェーハとセットとして考えれば、直接、四塩化ケイ素を製造することに比べて製造コストを低く抑えることができます。
四塩化ケイ素は、アルコキシシランの原料や乾式シリカ(フュームドシリカ)の 製造原料として使用されます。しかし、湿式法による合成シリカの原料であるケイ酸ソーダ(3号)と比較した場合、およそ20倍の価格差があります。
四塩化ケイ素とケイ酸ソーダの価格(¥/kg)
ケイ酸ソーダ(3号)7) ¥500
四塩化ケイ素8) ¥11000
TEOSの用途
シリコーン樹脂
TEOSはシリコーン樹脂の架橋剤として用いられていて、Si-OR結合の反応性を利用しています。
シリコーン(Silicone)とは、ケイ素と酸素からなるシロキサン結合(≡Si-O-Si≡)を主骨格とし、そのケイ素(Si)にメチル基(-CH3)などのアルキル基を主体とする有機基が結合したポリマーの総称です。
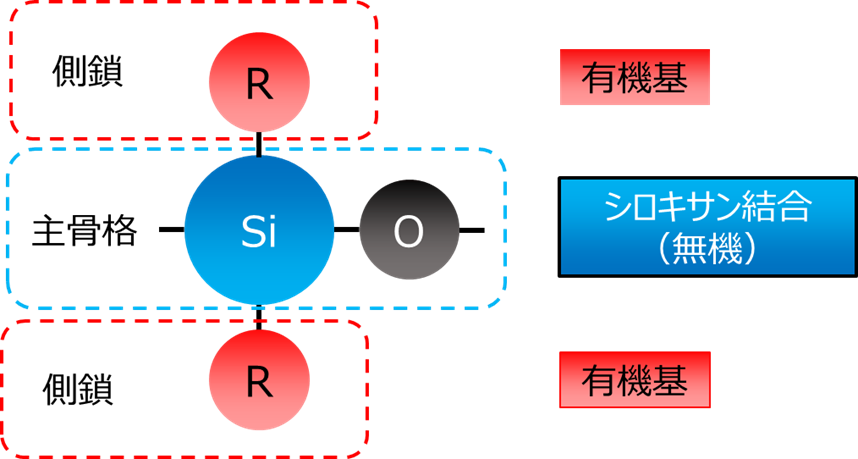
Fig5.シリコーンの基本構造
無機質のシロキサン結合と有機基との結び付きにより、無機と有機の特性をあわせ持った高機能ポリマー化合物で、形状は、オイル、ワニス、ゴム、エマルション、レジン(樹脂)と多様です。
シリコ—ンは、 ケイ素原子上に酸素原子が置換している数によって大きく特性が変化するため、酸素置換数によって、それぞれM(Mono)単位、D(Di)単位、T(Tri)単位、Q(Quartz)単位と分類でき、学術上、工業上、広く用いられています。
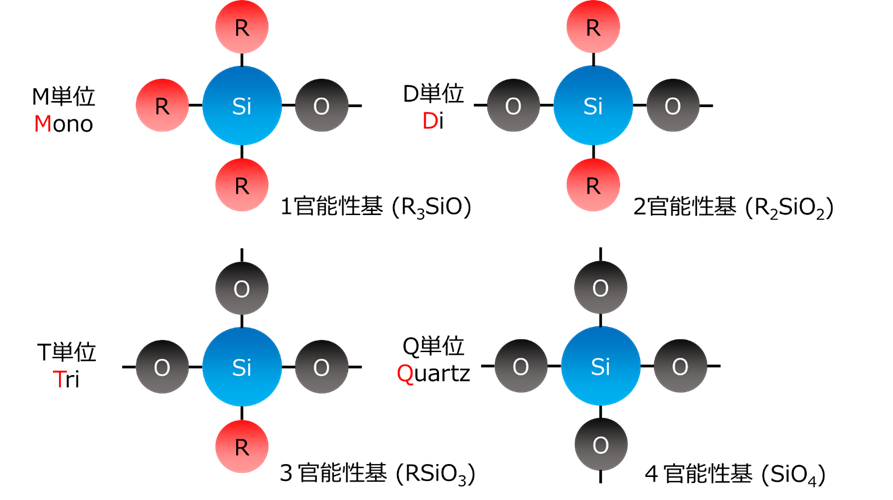
Fig6.シリコーンの基本単位
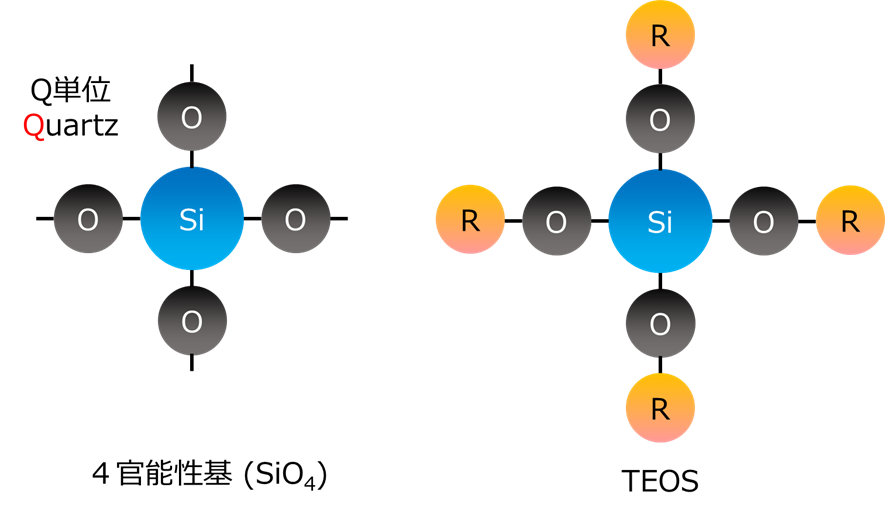
Fig7.Q単位とTEOS
薄膜
TEOSは、脱水縮合により比較的容易に緻密な膜を形成できるため、素子と配線との間の絶縁および空間充填や穴、配線パターンなどの形成用の耐エッチング膜配線層間の絶縁及び空間充填、更には不純物を遮蔽、 固定、吸収するための阻止膜の作成に用いられています。
保護膜の作成法は、ゾルゲル法やCVD法などがあります。
ゾルゲル法
コロイドの一種であるゾルを濃縮や重合反応によってゲル化する手順を経るためこの様によばれています。
更に狭義的な意味では、金属アルコキシドを出発原料とし、加水分解や重縮合反応からゾルおよびゲル状態を経由し、最終的には金属酸化物になる合成プロセスとなります。9)
このため、テトラアルコキシシランからシリカ一次粒子が形成する過程も狭義的な意味でのゾルゲル反応となります。
Fig8にテトラアルコキシシランのゾルゲル反応を示します。
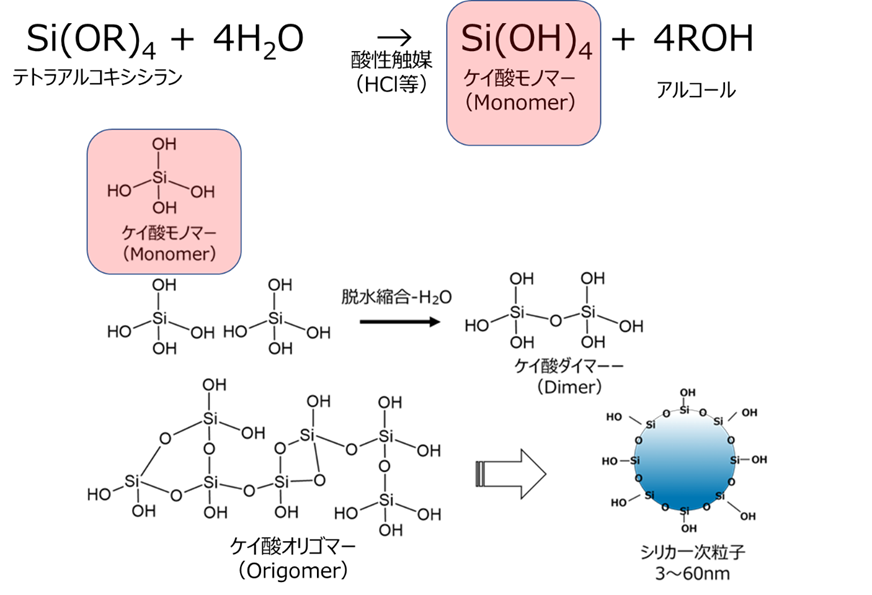
Fig8. テトラアルコキシシランによるゾルゲル反応
TEOSを塩酸等の酸性触媒下で加水分解させると、ケイ酸モノマー(Si(OH)4)が生成します。このケイ酸モノマーが脱水縮合することにより、ケイ酸ダイマー、オリゴマーを経て球状粒子が生成します。例えば、テトラアルコキシシラン(TEOS)をベースとした場合、副生成物としてエタノールが生成します。
テトラアルコキシシランによる保護膜の形成は、ゾルゲル法でオリゴマーまたは一次粒子を形成させてこれらを成膜させます。
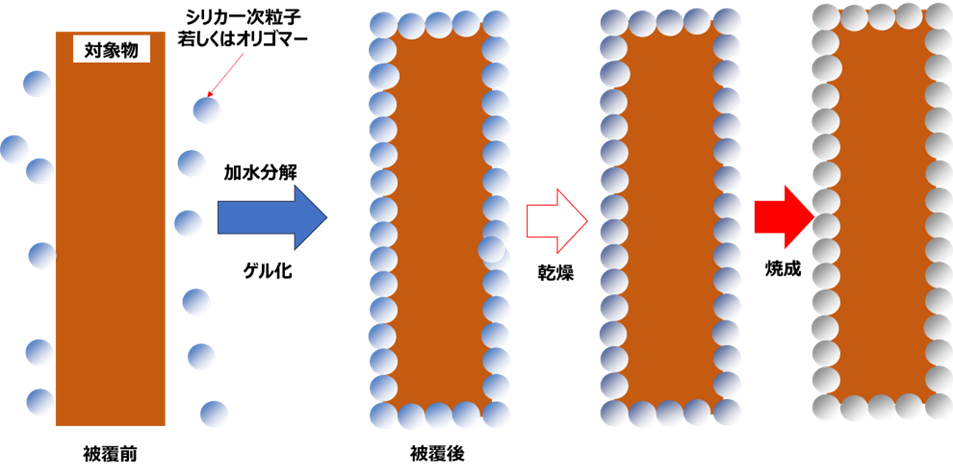
Fig9. シリカ一次粒子による保護膜の形成イメージ(断面図)
Fig9は、シリカ一次粒子による保護膜の形成イメージの断面図となります。対象物にシリカ一次粒子より保護膜が形成されます。この状態では強度が弱いため、乾燥や焼成を行いシリカ膜とすることにより強固な膜となります。このようにアルコキシシランを用いて作られた膜は、金属不純物を割合が少なくシリカ純度が高いものになります。
CVD法
CVDは、前述したように薄膜の成膜方法の一つです。
化学気相成長:Chemical Vapor Depositionの略で目的となる薄膜の原料ガス(気体)を供給し、熱、プラズマ、光などのエネルギーを与えて化学反応により膜を堆積する方法です。
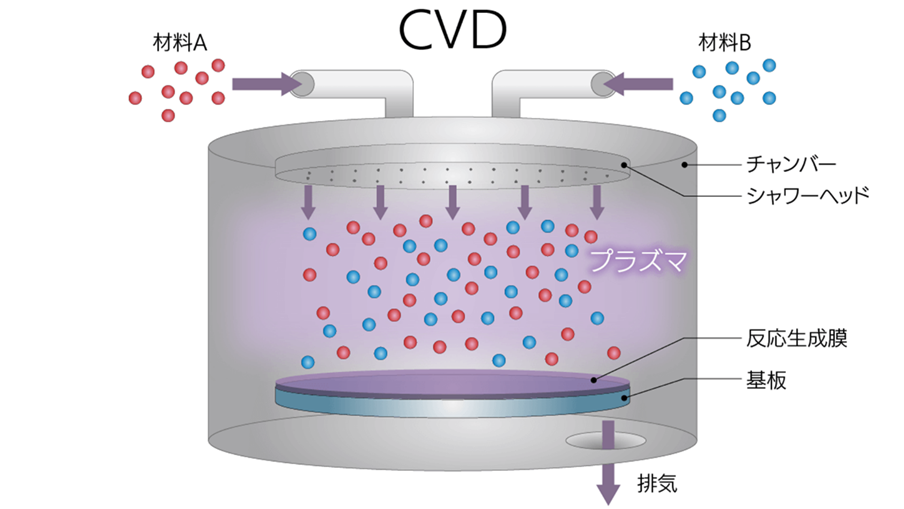
Fig10.プラズマを加熱源としたCVD法のイメージ10)
TEOSを用いた薄膜は半導体に用いられます。
半導体には、N型半導体、P型半導体があります。
n型半導体とは、電子を余分に持つ(負電荷を持つ)物質の自由電子によって電気伝導が起こる半導体です。マイナスの電荷を持つということから、負(Negative)の頭文字を取ってn型と呼ばれています。
一方、価電子帯に発生する電子の欠損部(ホール)を有している半導体をP型半導体といいます。プラス極側に隣り合う電子はホールに移動して、その移動により電子が伝わるため、見た目ではホールがプラス極へと移動していて、正(Positive)の電荷を持つことからP型半導体と呼ばれています。p型半導体は、シリコンにホウ素を加えたものが用いられています。
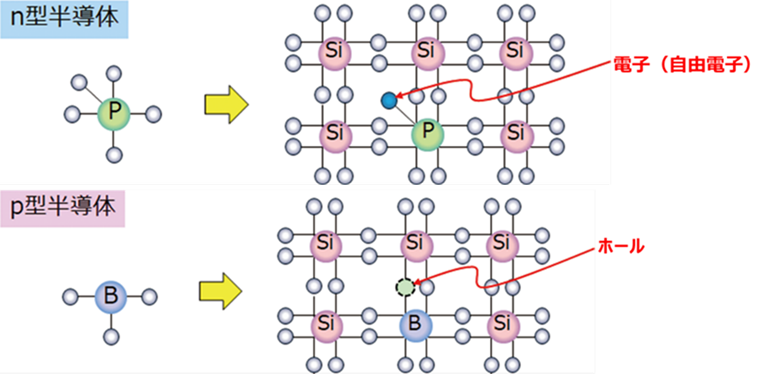
Fig11.N型半導体とP型半導体のイメージ11)
CVD法により、シリコン系の半導体薄膜を製造する場合、用いる材料は、高純度で気化しやすいことが要求されます。このため材料AとしてTEOSがよく用いられます。一方、材料Bについては金属有機物化合物が用いられ、N型半導体にはホウ素の有機化合物であるTMB(tetra-methyl bromide)やTEB(tetra-ethyl bromide)が用いられます。
P型半導体の場合は、材料Bにリンやリン酸の有機化合物としてTMP(Tetramethyl phosphonium) 、TMOP(Trimethyl phosphate)、TEOP(Triethyl phosphate)などが用いられます。
Table2.おもな半導体薄膜材料12)

P型半導体のTEOS薄膜は、P-TEOS呼ばれ、主に素子やメタル配線の保護に用いられる層間絶縁膜に用いられ、200~300℃の非常に低温で成膜が可能という特徴があります。
層間絶縁膜とは、N型半導体とP型半導体を隔離する膜で、P-TEOS膜は、P型半導体にシリカ膜をコートしたものになります。

Fig12.集積回路(LSI)の構造と層間絶縁膜13)
層間絶縁膜は比誘電率が4以上あり、配線と配線の間の容量を発生することから、大量の信号を高速にやり取りする場合、信号の遅延やクロストークによる誤動作が問題となります。これらを防ぐため、比誘電率3以下に抑えるための低誘電率化の検討が行われていて、今後5Gなど大量の信号を高速でやりとりするためには、いかに低誘電率を抑えるかがキーポイントとなります。
高純度コロイダルシリカ
高純度コロイダルシリカはアルコキシシランを用いて製造され、TEOSがよく用いられています。高純度シリカはシリコンウェーハの研磨剤として用いられていて、半導体製造には不可欠な材料の一つです。

Fig13.シリコンウェーハと研磨イメージ14), 15)
コロイダルシリカは、ケイ酸ソーダをシリカ源として製造する方法もありますが、半導体の研磨には高純度のコロイダルシリカが要求されるため、シリカ源としてTEOSなどのアルコキシシランを用いるものが主流です。大きさは20~50nmで、この領域は光の量子効果が関係してきます。
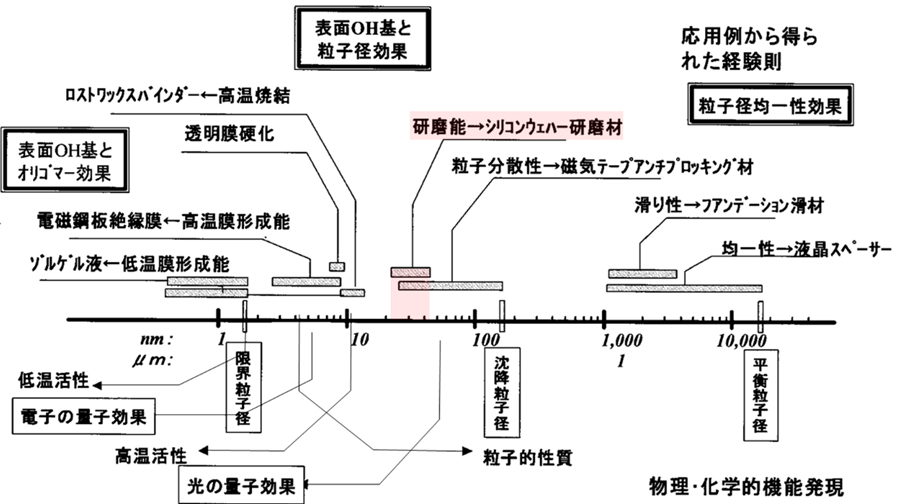
Fig14.コロイダルシリカの用途と粒子径とその機能16)
Fig15 にTEOSを用いたコロイダルシリカの製法の概略を示します。
テトラエトキシシラン(TEOS)に塩酸等の反応液を加えて加水分解反応により、Fig8のシリカコーティングと同様にモノマー、ダイマー、オリゴマーを経てシリカ一次粒子を形成させます。この一次粒子のスラリーを蒸留させて、エタノールを除去します。次にpH調整剤によりpH調整を行い、更に還流濃縮を行うことでコロイダルシリカとなります。
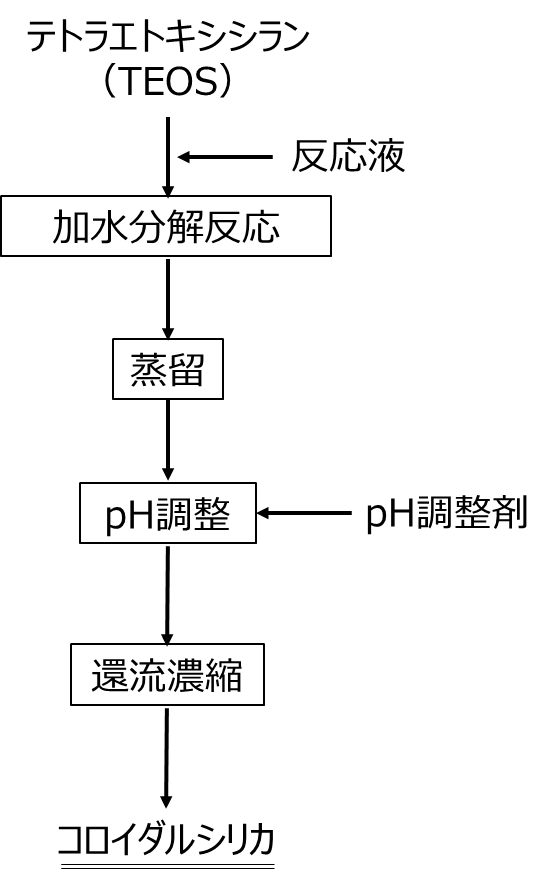
Fig15.TEOSを用いたコロイダルシリカの製法スキーム
技術的課題
TEOSをはじめとするアルコキシシランは、シリカ源として四塩化ケイ素を原料に製造されます。
四塩化ケイ素は、ケイ石を2000℃程度で還元焼成を行って金属ケイ素を作るため、膨大なエネルギーコストがかかります。
製造時の副産物であるため、直接四塩化ケイ素を製造するのに比べて製造コストは低く抑えられていますが、シリコンウェーハが四塩化ケイ素を算出しない別の方法で製造されるようになったら製造コストは確実に跳ね上がります。
また、金属ケイ素は、日本では石油危機の影響の1982年を最後に国内で生産するメーカーがなくなり、現在は全量輸入されています。主要生産国は比較的電気代の安い米国、ノルウェー、オーストラリア、ブラジル、南アフリカ、中国などで、世界の年間生産量は約90万トンです。
このため、信越化学では、100%子会社のシムコア社(オーストラリア)で金属ケイ素の製造をしています17)。
アルコキシシランの直接合成
上述した背景により、これまでシリカをからアルコキシシランの直接合成は昭和50 年代から試みられてきました18)。しかし、高温や高圧を要する、高価な触媒が必要、目的とするアルコキシシランの分離等の問題があり、残念ながら現在まで大量生産が可能な製造法は確立されおりません。
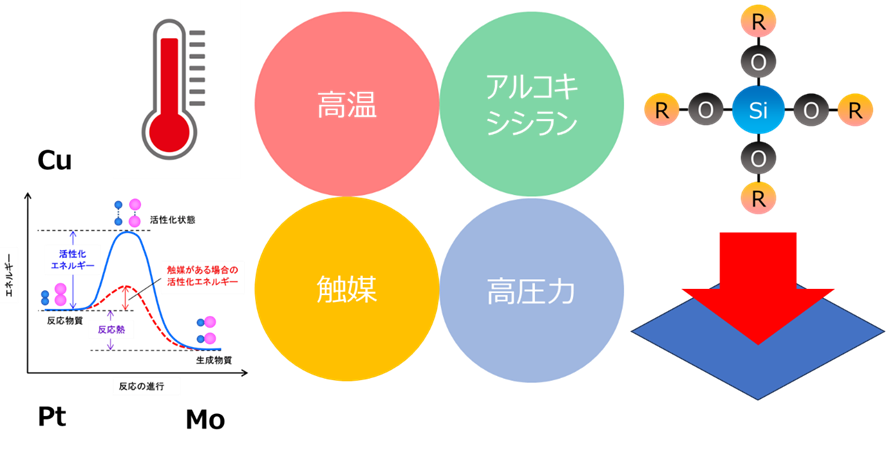
Fig16. シリカからアルコキシシランを製造するための技術的課題
最近では、産業技術総合研究所から、新規の金属ケイ素を用いないシリカからアルコキシシランの合成技術が報告されています。
この方法は、シリカにジアルコキシケトン((RO)2CO)を350℃にてヘリウム通気下で反応させてアルコキシラン(Si(OR)4)得る方法で、副産物ととして算出した二酸化炭素(CO2)をアルコール(ROH)と反応させることでジアルコキシケトンを得て、再びシリカとの反応用いる方法で、技術的はもとよりカーボンニュートラルの考え方からも非常に注目されています。
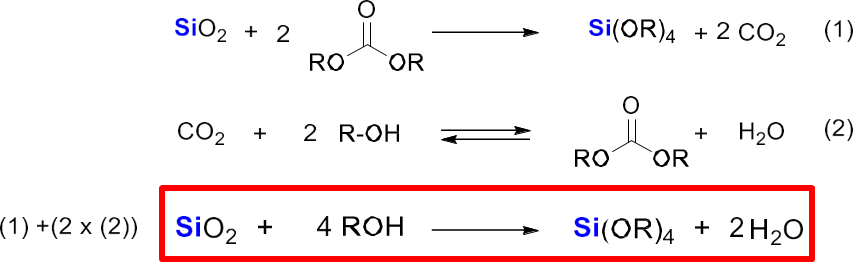
Fig17. 新規の金属ケイ素を用いないシリカからアルコキシシランの合成スキーム19)
まとめ
アルコキシシランは、ケイ素を真ん中にアルコキシル基が4つついた構造を有していて、テトラエトキシシラン(TEOS)がよく知られています。TEOSは、シリコン樹脂の架橋剤、半導体の絶縁膜、高純度のコロイダルシリカ等に使用されていて、なかでも高純度のコロイダルシリカはシリコンウェーハの研磨には不可欠な素材の一つです。このように、最先端の産業に密接な関係を持つことから、2024年から2030年の予測期間において、年間平均成長率(CAGR)5.8%で成長し、2030年までに3077.6百万米ドルに達すると予測されています20)
現在、アルコキシシランは、シリコンウェーハを製造する際に副産物として生じる四塩化ケイ素を原料に生産されています。四塩化ケイ素を作るためには、ケイ石を2000℃程度で還元焼成を行い金属ケイ素を作るため、膨大なエネルギーコストがかかります。現在は、シリコンウェーハ製造時の副産物であるため、直接四塩化ケイ素を製造するのに比べて製造コストは低く抑えられていますが、シリコンウェーハが四塩化ケイ素を算出しない別の方法で製造されるようになったら製造コストは確実に跳ね上がります。
また、金属ケイ素は、日本では石油危機の影響の1982年をもって国内で生産するメーカーがなくなり、現在は全量輸入されています。主要生産国は比較的電気代の安い米国、ノルウェー、オーストラリア、ブラジル、南アフリカ、中国などで生産されていているため、地政学的にも不安があります。
これらのリスクから、これまでシリカをからアルコキシシランの直接合成は昭和50 年代から試みられてきました。しかし、高温や高圧を要する、高価な触媒が必要、目的とするアルコキシシランの分離等の問題があり、残念ながら現在まで大量生産が可能な製造法は確立されておりません。
最近では、産業技術総合研究所から、新規の金属ケイ素を用いない、シリカからアルコキシシランの合成技術が報告されていて、この方法は、技術的はもとよりカーボンニュートラルの考え方からも非常に注目されています。シリカからアルコキシシランを容易に合成できれば、シリカ産業の更なる発展が期待されます。
私も、シリカの専門家のひとりとして期待しており、微力ではありますが、貢献できたらと常日頃から考えております。
参考文献
1)信越化学工業株式会社 https://www.silicone.jp/guide/classification/search_category/silane_coupling_agents/
2)多摩化学工業株式会社 製品安全データシートTAMA-DOP001-01-6
3)TNJ https://th.tnjchem.com/tetraethyl-orthosilicate_p1090.html
4)職場のあんぜんサイトhttps://anzeninfo.mhlw.go.jp/anzen/gmsds/0834.html
5)菊池正典 半導体産業のすべて 第2刷 ダイヤモンド社(2023)p.144
6)菊池正典 半導体産業のすべて 第2刷 ダイヤモンド社(2023)p.145
7)陶芸ショップ.com https://x.gd/zxi85
8)東京化成工業株式会社https://www.tcichemicals.com/JP/ja/p/T0636
9)土岐元幸 ゾルーゲル法のやさしい概要とその用途 表面技術Vol. 50, No2, (1999) p.116
10)株式会社ニデック https://coating.nidek.co.jp/article/information/ar/a64
11)新電元工業株式会社HPより引用、筆者一部改 https://www.shindengen.co.jp/products/semi/column/basic/semi/rectifying_action.html
12)株式会社高純度化学研究所 https://www.kojundo.co.jp/material/thin_film_material/cvd.html
13)国立研究開発法人産業技術総合研究所 https://www.aist.go.jp/aist_j/press_release/pr2002/pr20020325/pr20020325.html をもとに筆者作成
14)日経ビジネス https://business.nikkei.com/atcl/gen/19/00289/042600001/
15)一般社団法人日本半導体製造装置協会 https://www.seaj.or.jp/semi/proc/pre_process02.html
16)小松、 西田 ナノ材料としてのコロイダルシリカの機能と応用 SEN’I GAKKAISHI(繊維と工業)Vol.60, No.7(2004) p378図4を筆者加筆
17)信越化学工業株式会社 https://www.silicone.jp/contact/qa/qa001.shtml
18)公開特許公報 特開昭55-028929 エトキシシランの製造方法19)W. S. Putro, K. Fukaya, J. C. Choi, S. J. Choi, T. Horikoshi, K. Sato, N. Fukaya, Bull. Chem. Soc. Jpn. 2020, 93, 985
20)QY research アルコキシシラン―グローバル市場シェアとランキング、全体の売上と需要予測、2024~2030 https://www.qyresearch.co.jp/reports/790931/alkoxysilane

-300x188.png)

-300x188.png)
-300x188.png)


コメント