合成シリカ中の不純物
合成シリカの中に含まれる不純物は、金属系、有機系、その他に分けられ、原料由来のものと工程由来のものに分類されます。今回はその中で合成シリカの代表であるフュームドシリカ、シリカゲル、沈降性シリカ、コロイダルシリカ中の金属不純物について解説していきます。
合成シリカの中不純物とその由来
Fig1にフュームドシリカ、シリカゲル、沈降性シリカ、コロイダルシリカの製法、Fig2にその不純物と由来を示します。
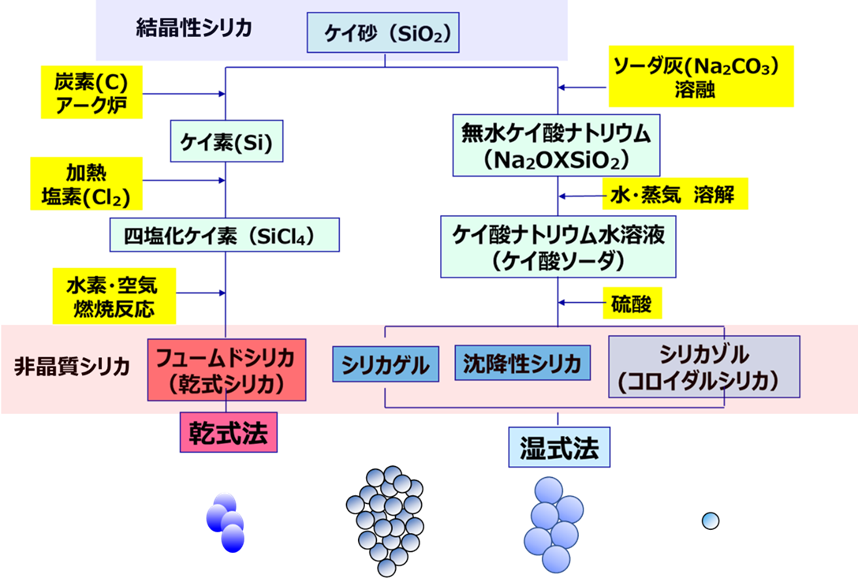
Fig1. おもな合成シリカの製造法

Fig2.おもな合成シリカとその不純物
不純物は金属の他に、有機物、塩酸由来の塩素(Cl)や硫酸由来の硫黄(S)などがあります。特に有機物については、フュームドシリカ、シリカゲル、沈降性シリカは表面にシラノールが露出しています。シラノール基は酢酸などの有機物を吸着しますので、保管中に有機物を吸着して黄色や茶色に変色してしまう場合があります。このように基本的に有機系不純物は原料由来ではありません。
金属不純物
Fig2で示すように金属不純物は、シリカゲル、沈降性シリカ、コロイダルシリカなどの湿式シリカにおいては、ケイ砂、ケイ酸ソーダ等に原料による由来が大きいものとなります。
また、シリカゲル、沈降性シリカには水洗という工程があり、この工程では、反応で生じた硫酸ナトリウムを除去します。しかし、その水洗水に金属元素が大量に含まれていると、かえって、水洗により水中の金属がシリカに吸着されてしまうため、水洗水の選定は重要となります。
どのシリカの工程にも金属製のタンクや配管が用いられています。このためこれらの金属の溶出が考えられますが、極微量であるため品質や性能に影響を及ぼすことはありません。しかし、溶出は極力抑える必要がありますので、使用環境に応じて適切なタンク、配管材料の選定は重要になります。
金属含有量は製造方法に大きく影響し、乾式法、湿式法で大きく異なります。
乾式法
Fig3にヒュームドシリカの製法(火炎加水分解法)を示します。
火炎加水分解法は、シリカ原として四塩化ケイ素を用い、1000℃程度の高温バーナー中で反応させる方法です。
反応を化学式で表すと、四塩化ケイ素が水素と酸素により加水分解されてシリカ単量体(SiO2)が生成します。この生成したシリカ単量体は塩酸が含まれているため、脱酸工程で塩酸を除去して製品となります。
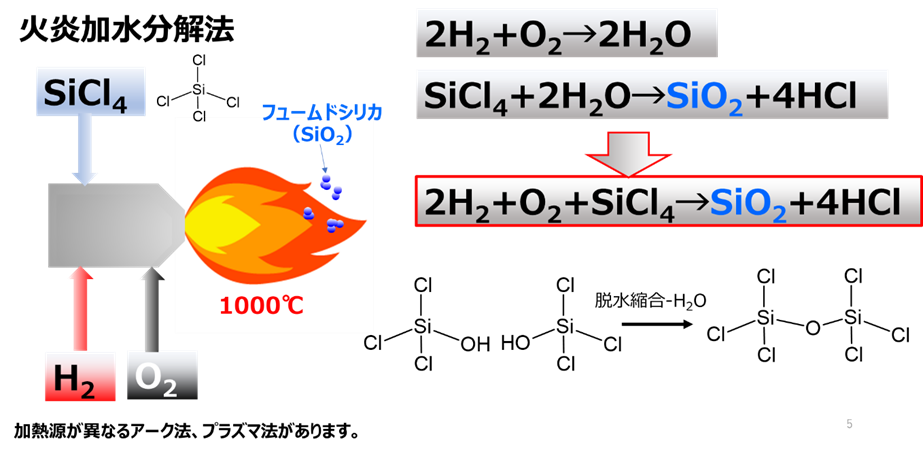
Fig3. ヒュームドシリカの製法(火炎加水分解法)
四塩化ケイ素はFig4で示すように、ケイ砂やケイ石から還元焼成により金属Siを作り、トリクロロシランを経て製造されます。このため、ケイ砂やケイ石由来の金属が含まれていないのが特長です・
この四塩化ケイ素を原料にヒュームドシリカは製造されるため、非常に金属不純物が少なく純度が高いシリカとなります。
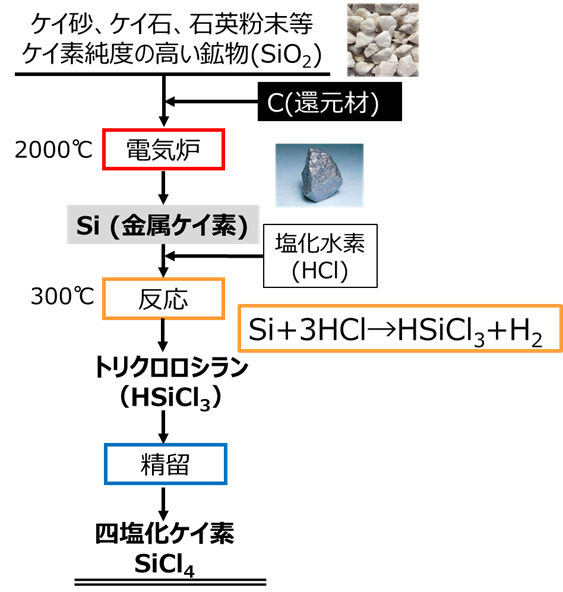
Fig4.四塩化ケイ素の製法
Table1に湿式シリカと金属シリカの金属不純物量を示します。
Table1. 湿式シリカと金属シリカの純度と金属不純物量1)

フュームドシリカのAl2O3、Fe2O3、Na2Oの含有量は、湿式シリカに比べ非常に低く、シリカ純度(SiO2 %)も湿式シリカ98%に比べてフュームドシリカ99.9%以上と高いことがわかります。
このため、ヒュームドシリカは他のシリカに比べて、金属不純物の割合が極めて少なく、シリカ純度が高いことが特長の一つとなります。
湿式法
Fig5にシリカゲル、Fig6に湿式シリカの製法を示します。
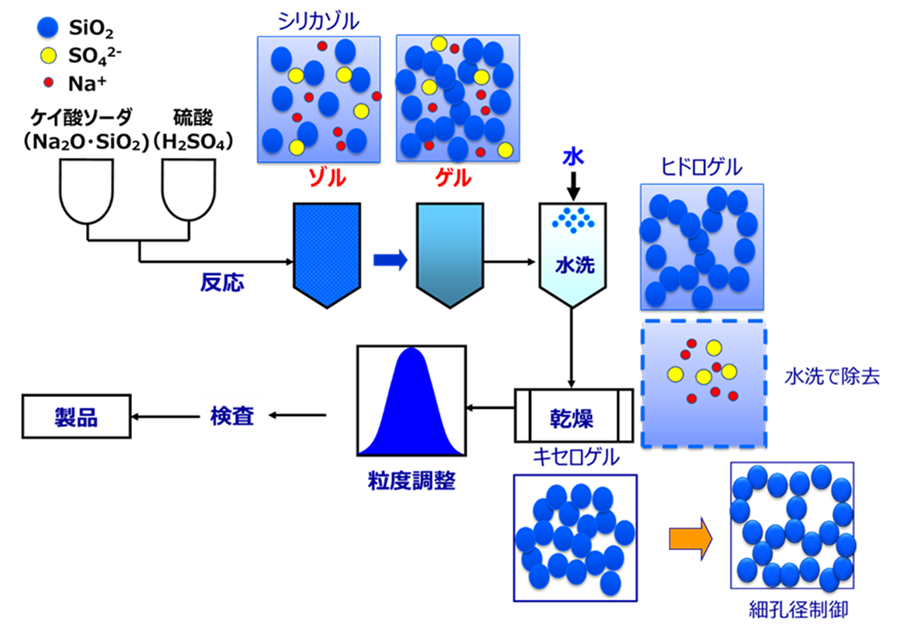
Fig5.シリカゲルの製造方法
工業的にシリカゲルは、ケイ酸ソーダと硫酸を反応させてゲル化をさせます。このゲル化したシリカゲルを水洗して、副産物として生じる塩(硫酸ナトリウム)を水で洗い除去します。
水洗後のシリカゲルは水分をたくさん含んでいるため、この状態をシリカヒドロゲルといいます。
シリカヒドロゲル大量の水が含まれているため、乾燥させて水分を除去します。
この水分を除去した状態をシリカヒドロゲルに対してシリカキセロゲルといいます。
シリカキセロゲルになることで二次粒子の骨格は強固になります。更に、グレードによっては細孔径を調整後、粒度を揃えて製品となります。
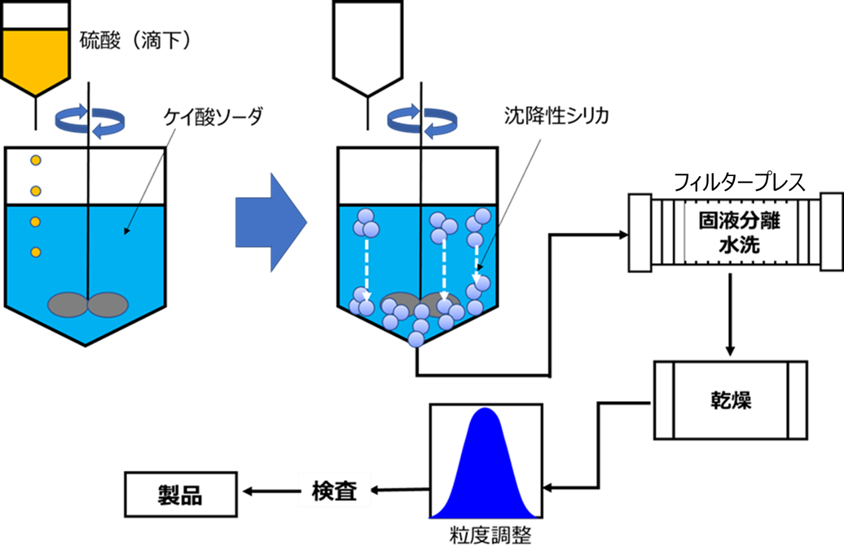
Fig6.沈降性シリカの製造方法
沈降性シリカは、ケイ酸ソーダを攪拌しながら硫酸を滴下、若しくはケイ酸ソーダ溶液と硫酸を水中に滴下して中和して沈降性シリカを生成させます。得られた沈降性シリカは液体中に分散している状態(シリカスラリーの状態)のため、固形成分(沈降性シリカ)をフィルタープレスなどで、分離・回収を行います。分離回収後、水を通水させて余分なケイ酸ソーダや硫酸を洗い流した後乾燥をさせます。その後、粒度調整を行い、検査を経て製品となります
シリカゲル、沈降性シリカはどちらもケイ酸ソーダ、硫酸を原料に製造されます。これら2つの原料中の金属不純物量が製品に影響します。
硫酸
以下に、濃硫酸の工業的製法である接触法の概要を示します2)。
接触法では次の3段階で製造されます。
まず、硫黄を燃焼酸化させて二酸化硫黄(SO2)を作ります。
①S+O2→SO2
次に精製したSO2を空気中の酸素で五酸化バナジウムの触媒の下で酸化させて三酸化硫黄(SO3)を作ります。
➁2SO2+O2(V2O5 cat)→2SO3
この段階において三酸化硫黄(SO3)の生成効率を高めるには、低温・高圧にすることが重要です。
低温にすると、ルシャトリエの原理により温度を上げる方向に反応が進みます。したがって、この反応は発熱反応なので、右(SO3が生成する方向)に反応が進みます。
更に、高圧にした場合、ルシャトリエの原理により圧力を下げる方向(気体分子数が少なくなる方向)に反応が進みます。この反応における気体分子数を比較すると、左は3、右は2なので、右に反応が進むことになります。
③SO3+H2O→H2SO4
化学式の上ではSO3に水を加えることで硫酸(H2SO4)ができることになりますが、硫酸の水に対する溶解熱(希釈熱)は880 kJ mol-13)と非常に高く、このため、硫酸に水を加えた場合沸騰をして硫酸が周囲に飛び散り非常に危険な状態になります。
このため、実際に硫酸を製造する際には、➁で得たSO3を濃硫酸に溶かして発煙硫酸とし、そこに希硫酸を加えることで発煙硫酸中のSO3と希硫酸中のH2Oが反応して沸騰せずに濃硫酸が得られます。
発煙硫酸とは、濃硫酸H2SO4に大量の三酸化硫黄SO3を吸収させたものになります。
硫酸は脱水能力が非常に高いためデシケーター中に入れて乾燥用途としてよく用いられます。更に硫酸の濃度で脱水能力がコントロールできるため、デシケーターに所定の濃度の硫酸を入れることで一定の相対湿度を維持できます。このため、シリカゲルの吸湿能力測定にも用いられています4)。
湿式シリカに使用する硫酸は希硫酸なので、大量に使用する場合はインラインミキサを用いた希釈装置により任意の濃度に希釈をするか、上述したように希硫酸に濃硫酸を加えていく方法がありますが、少量の場合は直接希硫酸を購入するケースもあります。
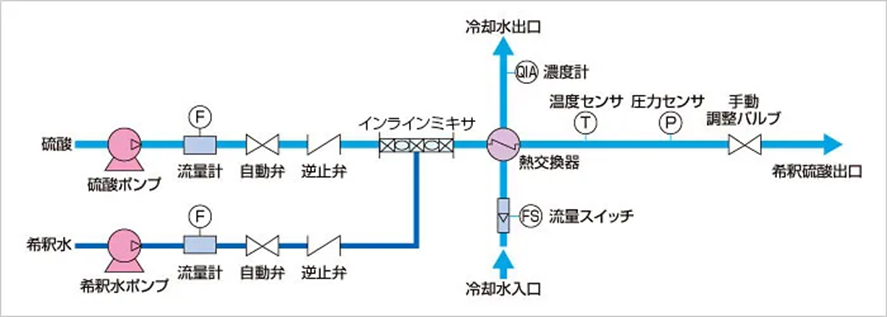
Fig7.希釈装置フロー図5)
Table2に工業用濃硫酸の品質規格6)を示します。
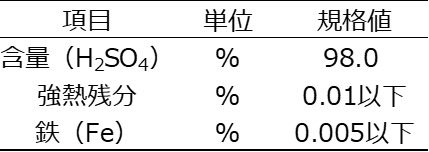
鉄が規格値7)として定められているのは、硫黄と鉄は地殻中で硫化鉄(黄銅鉱)を作りやすく、一昔前は、硫黄の燃焼ではなく、黄銅鉱(二硫化鉄)FeS2の燃焼により二酸化硫黄SO2を得ていた2)ことによるものと考えられます。
ケイ酸ソーダ
ケイ酸ソーダは、別名ケイ酸ナトリウム、水ガラスとも言われ、化学式ではNa2OXSiO2で表すことができます。Xはモル比といい、Na2OとSiO2のモル比を表し、ケイ酸ソーダの物性の重要な指標となります。

Fig8にケイ酸ソーダの製法を示します。
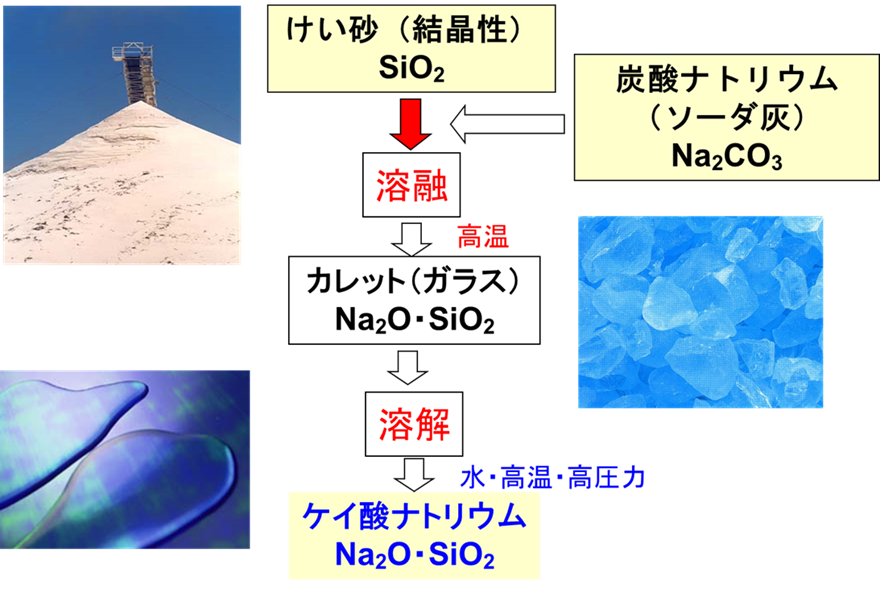
Fig8.ケイ酸ソーダの製造法
ケイ酸ソーダはまず、ケイ砂に炭酸ナトリウム(ソーダ灰)を加え、これを溶融することにより、カレットというガラスの一種を作ります。
このカレットに水を加えて、高温・高圧で溶解させたものがケイ酸ナトリウムとなります。
ケイ酸ナトリウムは、ナトリウムを大量に含む他、ケイ砂由来の金属不純物も含まれます。
このため、JISK1418では、ケイ酸ソーダの金属量は、酸化ナトリウム、鉄について次のように定義されています。また、水不溶物については、ケイ砂由来の金属が含まれています(Table3)。
Table3.ケイ酸ソーダの規格

JISK1408ケイ酸ナトリウム(ケイ酸ソーダ)規格一覧(2022年4月1日より日本無機協会規格に移行)
ちなみにケイ酸ソーダは液体ですが、メタケイ酸ナトリウムはモル比が異なるため、粒状の白色結晶の固体となります。
Table4にケイ砂中シリカ純度と金属含有量を示します。
able4.ケイ砂中のシリカ純度と金属含有量8)
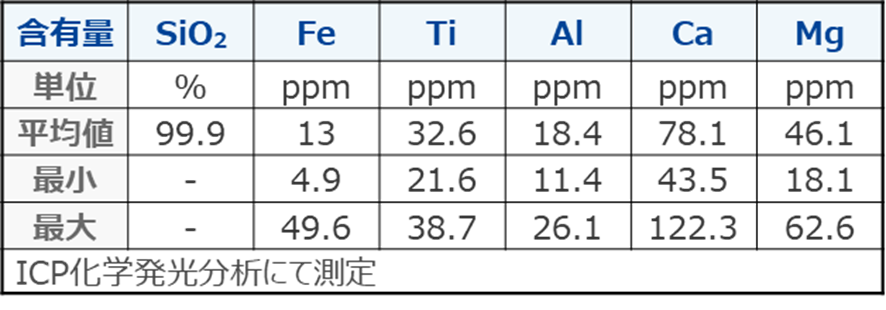
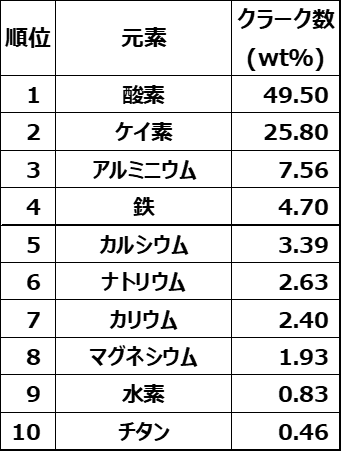
ケイ砂の金属含有量は、おおむねクラーク数に依存します。
クラーク数とは、地表部付近からおおよそ海水面下10マイル(16km)までと定めた地殻中の元素を存在割合順で示した数です。クラークらは上述した仮定をもとに、1924年に火成岩中の元素の割合を8,600個の岩石から求めた分析値と5,159個の試料の分析した平均値から推定しています。
Table4にクラーク数上位10元素を示します。
Table4.クラーク数上位10元素9)
反応と水洗
シリカゲルも沈降性シリカも硫酸とケイ酸ソーダを原料として用いられ、双方とも以下に示す化学反応式が基本となります。
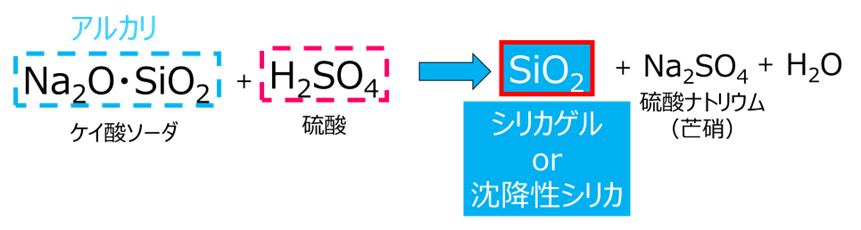
硫酸ナトリウムは水中で電離して、ナトリウムイオン(Na+)硫酸イオン(SO42-)となり、水洗という工程によりこれらを除去します。 水洗は、文字通り水により不純物を洗い流す工程で、原理的には普段みなさんが行っている洗濯のすすぎと同じです。

もう少し反応を詳しく見てみます。
例えば、モル比3.0のケイ酸ソーダの反応は次のようになります。
モル比3.0のケイ酸ソーダは、酸化ナトリウム(Na2O)1molに対してシリカ(SiO2)は3.0molあり、その構造は以下のようになります。
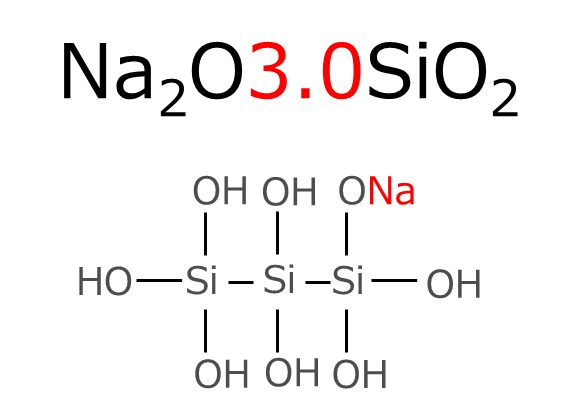
モル比(MR)3.0のケイ酸ソーダは、硫酸と反応してONaがOHに置換されてナトリウムイオン
(Na+)となり、硫酸由来の硫酸イオン(SO42-)と一緒に水洗で洗い流されます。
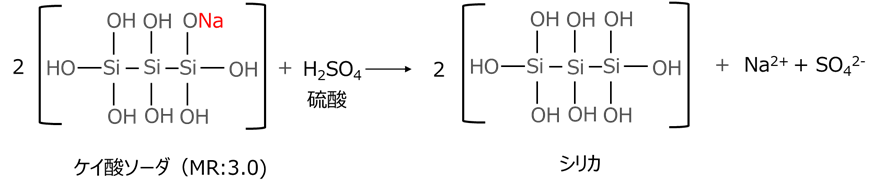
水洗は、Fig9のように進行します。
反応により、生成したナトリウムと硫酸はイオンとなって水洗中に存在していて、そこに水洗水がくると、これらイオンが除去されることになります。
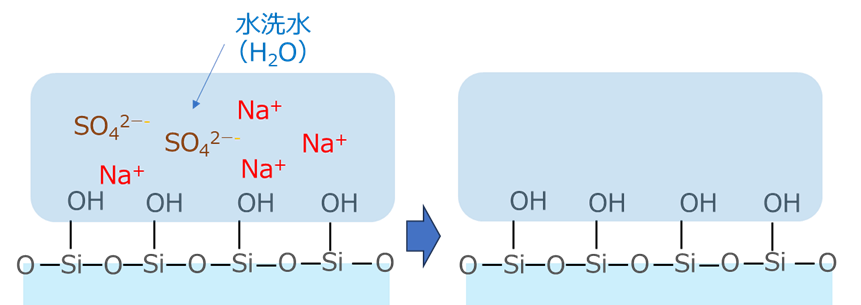
Fig9.シリカ表面における水洗の進行(イメージ)
シリカゲルや沈降性シリカなどの湿式シリカの反応ではシリカモノマーのSi‐OHのOHが脱水縮合してゲル化が進み、球状のシリカ一次粒子が形成され、この一次粒子から二次粒子が形成され3次元ゲル構造が発達してこれを、水洗、乾燥して製品となります。
Fig10に湿式法における3次元ゲル構造の形成モデルを示します。
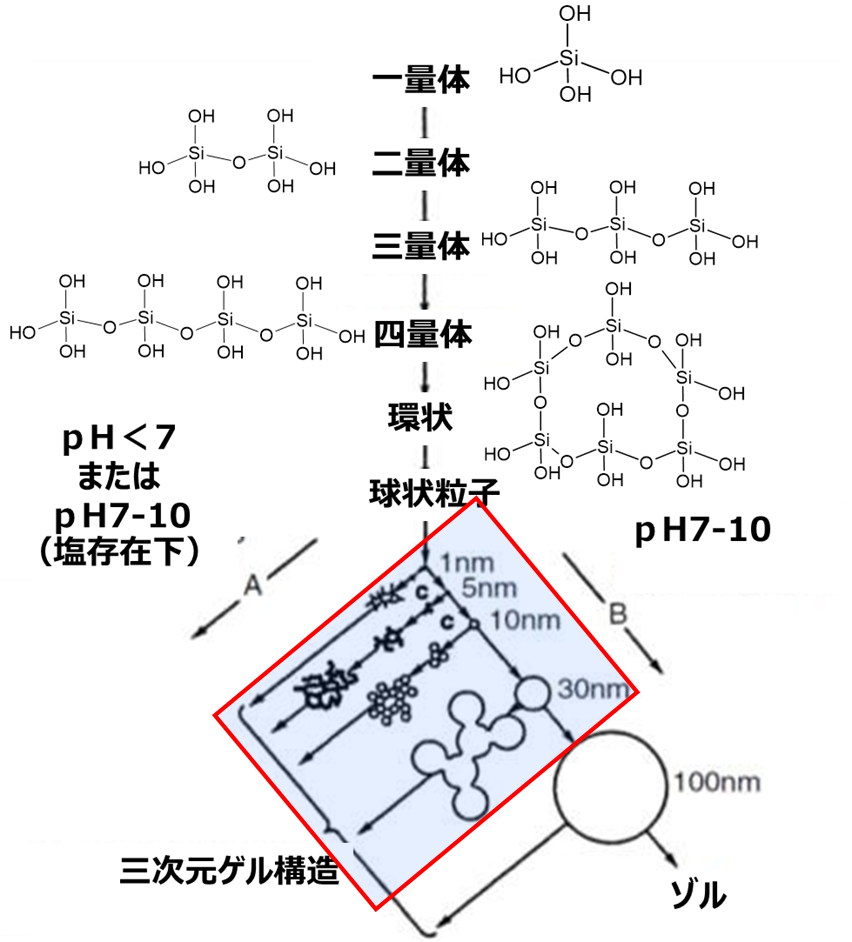
Fig10.湿式法における3次元ゲル構造の形成モデル
しかし、水洗工程ですべてのNaを除去することは難しく、一部のNa+は、表面でONaの状態のままになっていたり、ゲル化によりシリカ骨格に取り込まれてしまっているものがあります(Fig11)。
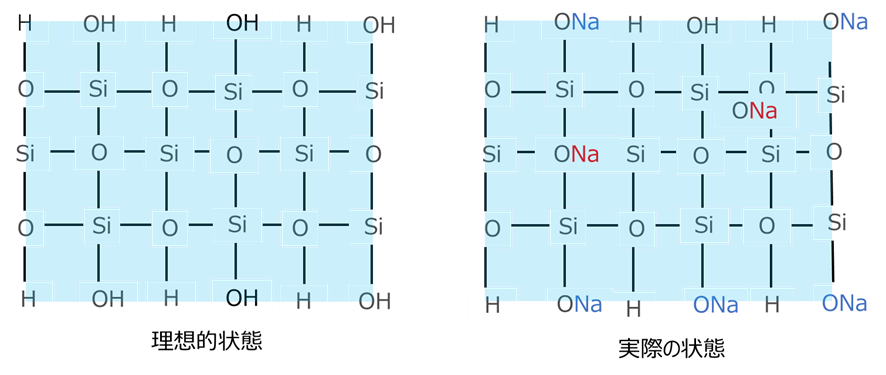
Fig11.ゲル化におけるシリカの理想的な状態と実際の状態
このとき、シリカ表面によるNaは水洗を工夫することで除去できますが、後者は除去することができません。
また、水洗水にたくさんの不純物が含まれていると、かえって水洗によりシリカが汚染されてしまうため、できるだけきれいな水で水洗する必要があります。イオン交換水や蒸留水で水洗する方法がありますが、シリカの水洗には大量の水が必要になるため、すべての水洗にこれらの水を使用するにはコストがかかるため、通常は工業用水が用いられ、高純度のものなどを製造する場合にイオン交換水や蒸留水が用いられる場合があります。
このようにシリカゲルや沈降性シリカなどの湿式シリカを製造するためには、水が非常に重要となり、きれいな工業用水が得られる場所が工場の立地条件の一つとなります。
また、ナトリウム以外の金属でも上述した現象が起こる場合があり、これら金属は原料のケイ砂や、硫酸に由来しますので、シリカ純度の高いものを得るには、ケイ砂も硫酸も高純度のものを使用する必要があります。
過剰水洗
上述した理由により、比較的金属含有量が少ないきれいな水が確保できる場所で湿式シリカは製造されますが、工業用水にはさまざまな金属元素が含まれているため、水洗が過剰に行われると、せっかくきれいになったシリカに工業用水由来の金属が吸着してしまう場合があります。これらも金属不純物の原因となり、このような状態を過剰水洗といいます。
よくあるのが、シリカと吸着の相性がよいカルシウムイオンが吸着されてしまう場合で、Fig10にイメージを示しておきます。
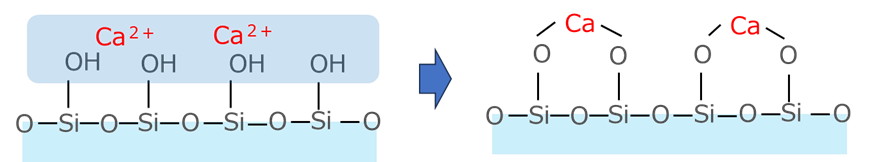
Fig10.過剰水洗によるCaイオンの吸着(イメージ)
水洗の評価
先に述べたように、水洗をし過ぎると水洗水中の金属が吸着されてしまい、過剰水洗状態になってしまいます。このため、水洗をいつ止めるかは、湿式シリカを製造する上で重要となります。
水洗終了の見極めは、電気伝導率(電導度)とpHで行うのが一般的で、水洗水とシリカスラリーで評価します。
測定原理と方法
pH
pHは、ペーハーやピーエッチと呼ばれ、水素イオン濃度の略称であり、溶液中の水素イオンの濃度を指し次の式で表されます10)。

純粋な水は水分子のまま安定しているわけではなく、水素イオンと水酸化イオンに電離をしたり、水分子に戻ったりを繰り返しています。
この水素イオンと水酸化物イオンとしてこの電離している割合を電離度(α)といいます。

このとき生じているH+の濃度が高いか低いかを示す尺度がpHです。水中のpHは溶けている物質や温度に応じて様々な値をとります。
更に、H+とOH–は、両者の濃度を掛けた値が一定となります。

(1)の式を用いて換算すると(3)になります。

普通は両者を足して14が最大となります。
測定原理
pHを測定する電極にはさまざまな種類があります。水洗水やシリカのスラリーpHはガラス電極によって測定するのが一般的です。ガラス電極法は測定反応が早く、再現性が良い為、現在のpH測定では最も多く用いられている測定方法です。また、酸化・還元剤の影響を受けることがなく、測定対象を選ばない利点があります。
ガラス電極法とは、pHガラス電極と比較電極の2本の電極を用い、この2つの電極の間に生じた電圧(電位差)を知ることで、ある溶液のpHを測定する方法です。
ガラスの薄膜の内側・外側にpHの異なる溶液があると、薄膜部分にpHの差に比例した起電力が生じます。この薄膜を「pHガラス応答膜」と言います。
理論上、溶液が25℃の場合2つの溶液のpHの差が1違えば、約59mVの起電力が生じます。
通常、pHガラス電極の内部液にはpH7の液を用いるため、pHガラス応答膜に生じた起電力を測定すれば、サンプルのpH値がわかります。
pHガラス応答膜に生じた起電力を測定するには、もう1本電極が必要です。このpHガラス電極と一対のもう1本の電極が「比較電極」です。比較電極は、電位が極めて安定した電極でなければならず、そのために液絡部にピンホールを開けたり、セラミックを施したりしています。12)
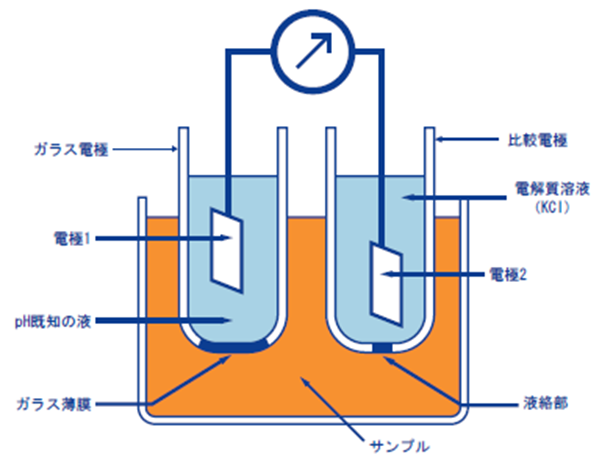
Fig11.ガラス電極の構造11)
電気伝導率(電導度)
電気伝導率(電導度)は、ものが、水中でどの程度電気を通しやすいかを表す指標となる値です。
電気の通しにくさ(電気抵抗)はオーム(Ω)という単位で表されることは、みなさんご存じかと思います。このΩの逆数いわゆる電気抵抗の逆数は、電気の通しやすさということなるため、これをジーメンス(S)という単位で表します。
一般的に電気伝導率を表す場合、Sではなく単位長さ当たりの量である比伝導率Sm-1(S/m)を用いて表します。これは、単位長さ当たりで電気伝導率を表す方が、物質の性質を示すのに都合がよいためで、導電率計の目盛としてはmS/cmやµS/cmが多く用いられています12)。
導電率計は、2つの電極間に交流電圧をかけて電気伝導率を測定する装置です。水の電気伝導率はイオン性の不純物が多いほど上昇するため、水の汚れ具合を反映する重要な水質監視項目となっています。この他、導電率計は海水や食品中の塩分含量の測定、大気中の二酸化硫黄濃度測定等に応用されています。ラボではイオンクロマトグラフ装置の検出器に用いられている場合があります。この際、あらかじめサンプルや溶離液中の電気伝導率やpHを調節することにより物質のカラム吸着量や溶出量をモニターしたり、制御する目安として用いられることがあり、シリカの測定にも利用されています。
測定原理
電気伝導率計の多くは、溶液に浸した電極間に電気を流すことで電気の伝導率を測定することを原理とします。
水溶液の場合は、電極間の距離を1cm、対向面積1cm2の立方体を想定した液体の電気伝導率として考える場合が多く、その単位はμS/cmです。電極の形状は、平板に限らず平行棒や同軸棒形状をしていることもあり、また電気信号は分極を防ぐために直流ではなく交流信号を用いています。
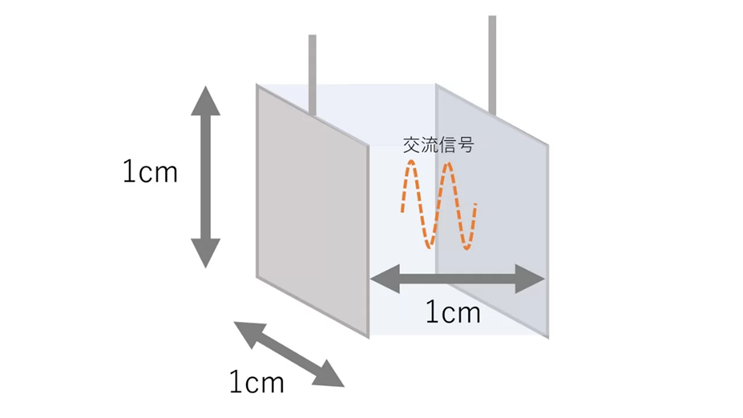
Fig12.電導度計の測定原理と電極13)
水洗水
水洗初期には、水洗水の中にたくさんのNa+やSO42-が残存しているため電導度は高くなります。一方、pHにおいては、硫酸から電離した水素イオンにより低くなります。
Fig13は、水洗初期の水洗水に含まれる主なイオンのイメージです。シリカを水洗しているため、もちろんケイ酸イオンも含まれますが、今回は除外しています。
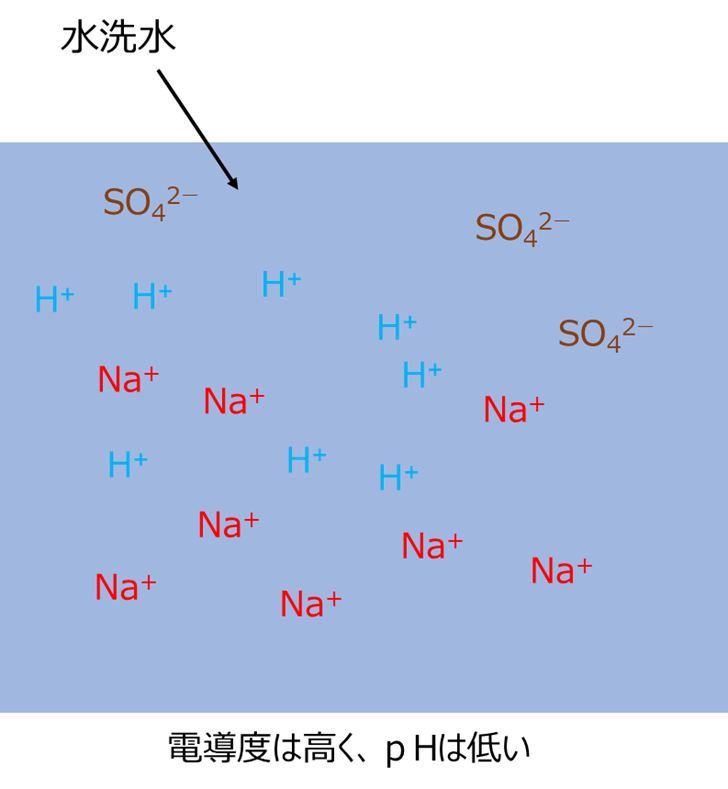
Fig13.水洗初期の水洗水に含まれる主なイオンのイメージ(ケイ酸イオンは除外)
シリカ
一方、シリカでの評価はスラリー状態にして行います。
スラリーとは懸濁液のことで、シリカスラリーとは、ミクロンサイズのシリカが水中に分散した状態の液です。水洗水同様、この懸濁液にNa+やSO42-が残存していると電導度は高くなります。
一方、pHにおいては、硫酸から電離した水素イオンにより低くなります。
サンプルが大きい場合は、粉砕、解砕して水に分散させてシリカスラリーを作成します。このとき注意しなくてはいけないのが、攪拌時間と攪拌力を一定にすることです。攪拌時間と攪拌力を一定にしないと測定条件がばらつくため、正しい値が得られません。
このときサンプルは水を含んでいてヒドロゲルの状態のため、その水分量を考慮して濃度を設定する必要があります。ちなみにスラリー濃度は、4~5wt%が一般的です。
例えば、5wt%のスラリー溶液100gを作成する場合に必要な水分80%のシリカヒドロゲルとイオン交換水の必要量は次のようになります。
5%スラリー溶液100gを作成するために必要なシリカは5g、イオン交換水は95g必要です。
水分80%シリカヒドロゲルには20%のシリカが含まれているため5g×(1/0.2)=25gとなり25gのシリカヒドロゲルが必要となります。
このとき25gのシリカヒドロゲルには水が20g含まれているため、95gのイオン交換水から20mlを差し引かなければなりません。
よって、水分80%のシリカヒドロゲル25g、イオン交換水は75g必要ということになります。
Fig14に沈降性シリカの測定イメージを示します。
サンプリングした沈降性シリカをイオン交換水中に投入して攪拌すると、沈降性シリカに付着もしくは含まれていたNa+、SO42-、H⁺イオンが水中に溶出してきます。これらの溶出量は水洗の進行により減少し、電導度、pHが変化しなくなった時点で水洗終了となります。
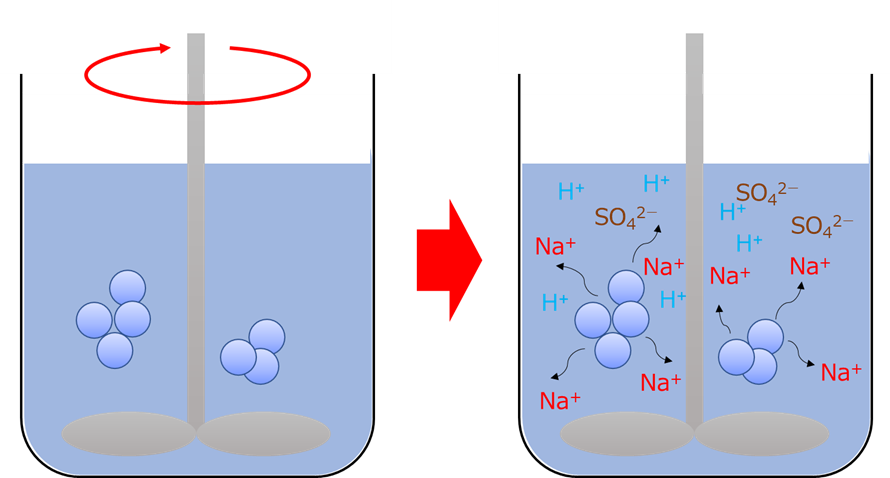
Fig14.沈降性シリカの測定イメージ
通常反応後のシリカは、Naを除去するために硫酸が過剰で酸性です。このため、水洗の進行により酸性から中性に近づくため、pHは増加していき、その一方電導度は金属イオンが減少するため電導度は低下します。
これらの現象は水洗水、シリカスラリー共通の現象です。
このとき、水洗の終点は両者が変化しなくなった時点になります。
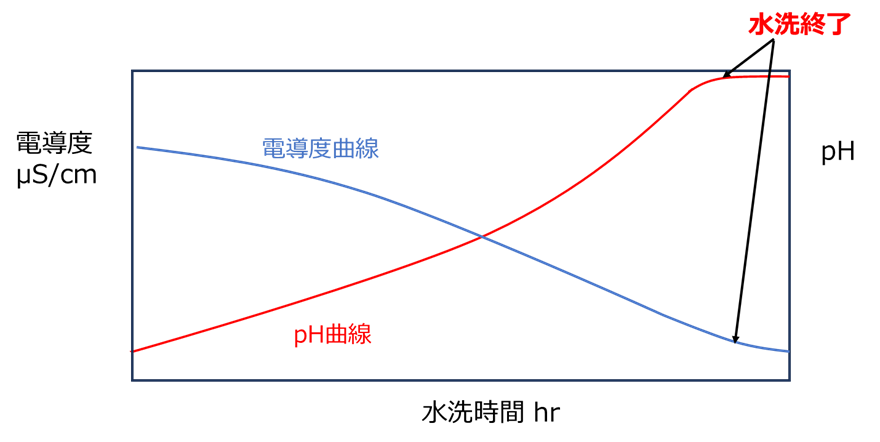
Fig15.水洗における電導度曲線とpH曲線および水洗終了のポイント
まとめ
合成シリカの内、乾式シリカであるヒュームドシリカは、四塩化ケイ素に水素と酸素を吹き込んで燃焼させる火炎加水分解法で製造されるため、金属不純物量は非常に低いものとなります。
一方、シリカゲルや沈降性シリカなどの湿式シリカは、フュームドシリカに比べて金属不純物が多く、ケイ酸ソーダや硫酸からの原料由来が多くを占めます。特に、ナトリウムについては、ケイ酸ソーダ製造時に添加する炭酸ナトリウムからのものになります。更に、ケイ砂からの由来として、鉄、チタン、マグネシウム、アルミニウム、カルシウムなどが挙げられます。
ナトリウムは、ケイ酸ソーダを添加して中和するときに理論上除去されるはずですが、同時にゲル化も起こっているため、シリカ表面に残存したり、骨格内に取り込まれてシリカに残存ずる場合があります。
シリカ表面に残存するものについては、水洗を工夫することで除去できますが、完全に除去することは難しく、更に、シリカ骨格内に埋没したナトリウムについては水洗水と接触しないために除去できません。
また、この現象は、ナトリウムばかりでなく、他の含有金属でも起こりえます。
更に、水洗水に含有している金属が吸着する場合があり、特にカルシウムはシリカに吸着されやすいため、水洗によりせっかくナトリウムが除去されたのにもかかわらず、更に水洗を継続した場合、今度はカルシウムを吸着してしまう場合があり、この現象を過剰水洗といいます。
純度の高いシリカを作るには、水洗工程は重要であり、水洗水、シリカスラリーのpH、電導度によってコントロールされています。
今回、合成シリカの金属不純物の種類と由来、更には残存する原因を中心に解説をしてきました。
次回は、これら金属の測定方法について解説をしていこうと思いますのでご期待ください。
参考文献
1) 落合 満 エアロゾル研究 Vol.5 No.1 (1990) p33をもとに筆者作成
2)化学のグルメ https://kimika.net/m2sessyoku.html
3)東邦大学理学部化学科 https://www.toho-u.ac.jp/sci/chem/column/6919/index.html
4)日本工業規格JIS Z 0701-1977
5)(株)イワキ https://www.iwakipumps.jp/products/flowrate-pressure-control/sulfuric_acid_dilution/
6)高杉製薬(株)工業用濃硫酸(98%)品質規格書(管理コード:133C77C)より引用
7)日本工業規格JIS K1321-1994
8)兆光實業有限公司 https://ja.choko.asia/about-us.htm
9)クラーク数 http://sulect.web.fc2.com/kura-ku-su/
10)鈴研(株)https://www.suzuken-ltd.co.jp/choose/ph/
11)(株)堀場製作所LAQUA https://www.horiba.com/jpn/water-quality/support/electrochemistry/the-basis-of-ph/measuring-ph-using-a-glass-electrode/
12)研究用語辞典 https://www.wdb.com/kenq/dictionary/electric-conductivity
13)オルガノ(株)Lab Salon https://puric.organo.co.jp/column/electrical-conductivity/

-300x188.png)

-300x188.png)
-300x188.png)


コメント